BIOLOGIE
Les techniques d’investigation du microbiome
La bactériologie classique
La biologie moléculaire
La bactériologie classique
1. Recueil de l’échantillon : prélèvement vaginal, prélèvement d’urines…
2. Examen direct du prélèvement
3. Mise en culture et isolement
4. Identification par des caractères phénotypiques
5. Étude de la sensibilité aux anti-infectieux
La biologie moléculaire
Les tests d’amplification génique comme la PCR , l’hybridation moléculaire ou le séquençage d’ADN ont amélioré le dépistage de micro-organismes difficilement ou non cultivables. L’utilisation de tests multiplex PCR permet la mise en évidence sur un seul échantillon de plusieurs pathogènes et donc d’augmenter la sensibilité diagnostique.
Pour l’étude de la composition des microbiomes, on utilise les tests de séquençage à haut débit (next-generation sequencing : NGS) qui permettent de séquencer très rapidement l’ADN ou l’ARN d’un échantillon et de le comparer à des génomes de référence.
Le microbiote vaginal
Composition
Variations physiologiques
Menstruation
Grossesse
Post-partum
Activité sexuelle
Composition
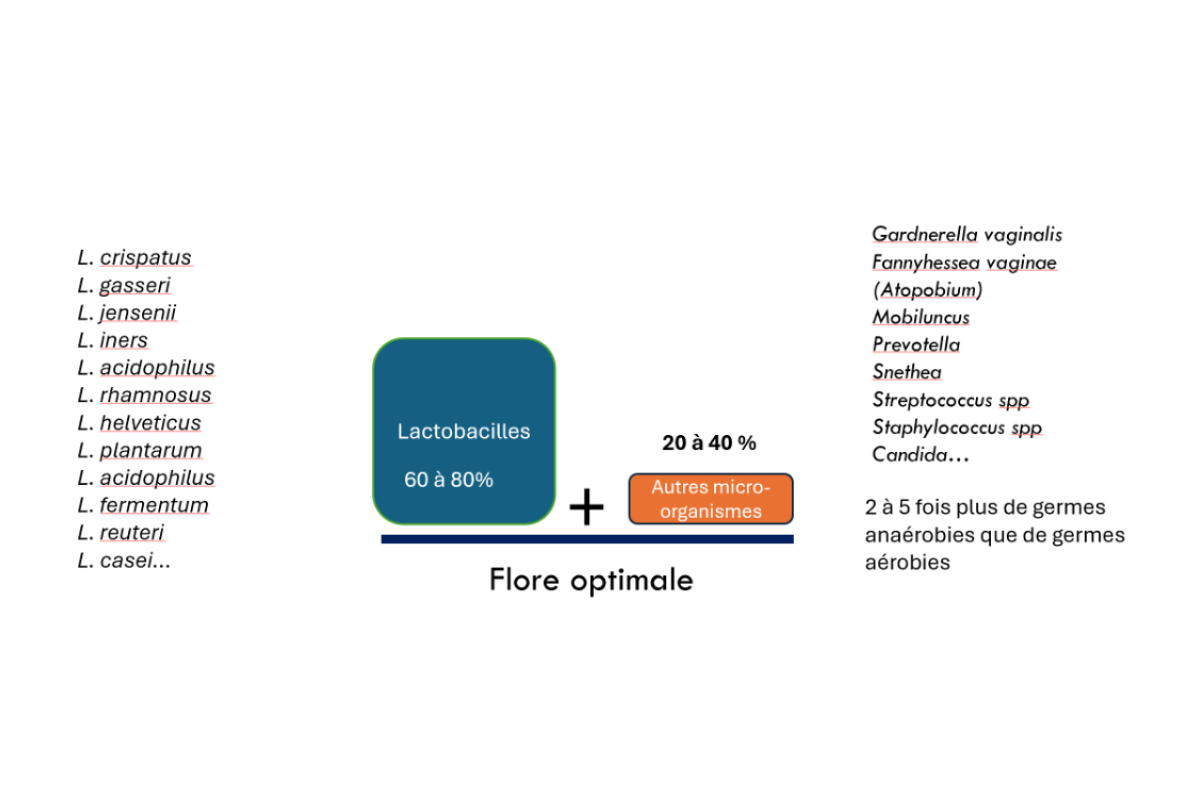
Le microbiote vaginal est composé de bactéries, de virus, de parasites et de levures. Chez la femme adulte non ménopausée, on considère qu’un microbiote bactérien optimal est dominé par des lactobacilles qui représentent environ 60 à 70 % des bactéries vaginales. Le reste du microbiote est composé majoritairement de bactéries anaérobies strictes ou facultatives.
Parmi la vingtaine d’espèces de lactobacilles susceptibles de se développer dans le vagin, Lactobacillus crispatus apparaît comme le plus protecteur pour l’équilibre du microbiome alors que Lactobacillus iners l’est moins. (cf fig 1)
Le microbiote vaginal optimal est peu diversifié contrairement au microbiote intestinal. Il est par ailleurs dynamique, c’est-à-dire variable dans le temps en fonction de facteurs endogènes (cycle menstruel par exemple) ou exogènes (rapports sexuels, antibiotiques…) avec un haut pouvoir de résilience.
Une classification de la composition du microbiote vaginal en fonction de la dominance ou non par des lactobacilles a été publiée par J. Ravel et al en 2020 (classification VALENCIA) avec 7 communautés bactériennes dont 4 dominées par des lactobacilles (microbiote optimal) et 3 non dominées par des lactobacilles (microbiote non optimal) (cf fig 2)
De grandes variations dans la composition de ce microbiote peuvent être observées en fonction des localisations géographiques et de l’ethnicité.
Variations physiologiques
À la naissance, le microbiome vaginal est dominé par des Lactobacilles car la mère transmet via le placenta des oestrogènes qui favorisent le développement de ces bactéries. Mais quelques jours après la naissance, l’imprégnation oestrogénique en provenance de la mère va se tarir et les lactobacilles vont progressivement disparaître et le microbiote vaginal sera composé de micro-organismes d’origine fécale, cutanée et environnementale.
Pendant l’enfance, l’imprégnation œstrogénique est insignifiante ou nulle.
La flore vaginale est donc constituée de micro-organismes d’origine cutanée et fécale (colibacilles, staphylocoques…) : des bactéries aérobies (Staphyococcus epidermidis, Enterococcus, Escherichia coli essentiellement)
et, de manière dominante, des bactéries anaérobies (Bacteroides, Peptococcus, etc) ainsi que des bactéries ana-aérobies comme Streptocoques β-hémolytique.
Notons que la levure du genre Candida n’a pas été identifié dans les études sur le microbiote des petites filles.
Chez la femme adulte non ménopausée, le microbiote vaginal optimal est peu diversifié et dominé par des lactobacilles. La composition de ce microbiote varie au cours du cycle menstruel car il est hormono-dépendant. En effet, les lactobacilles utilisent le glycogène vaginal comme nutriment et le taux de glycogène est étroitement dépendant du taux d’oestrogènes. On dit que le microbiote vaginal est :
• dynamique, c’est-à-dire susceptible de variations de composition en fonction de l’environnement en particulier hormonal
• et résilient car après une modification transitoire, il est susceptible de revenir à sa composition initiale
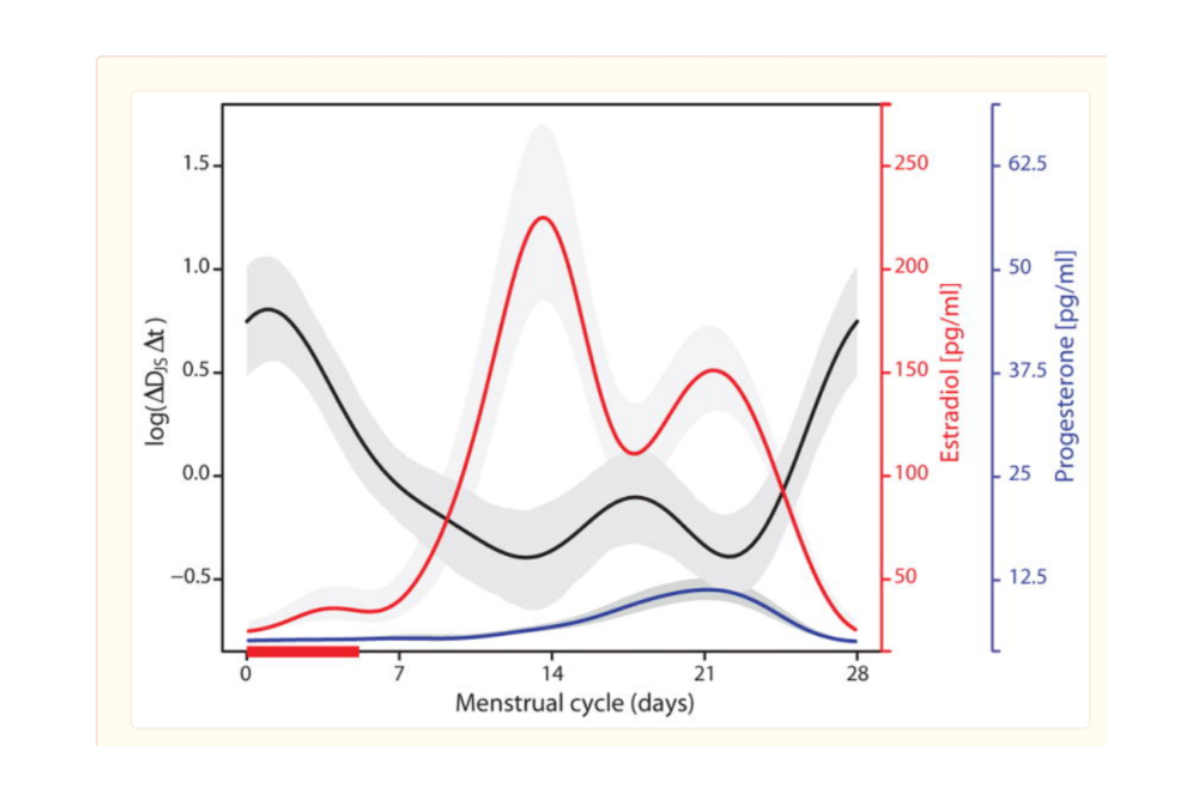
C’est ainsi que la diversité du microbiote vaginal est inversement corrélée aux taux d’oestrogènes (cf fig 3) :
Pendant la 1ere partie du cycle menstruel, la diversité du microbiote est faible correspondant à la concentration maximale d’oestrogènes. En revanche, au cours de la seconde partie du cycle, le taux d’oestrogènes diminuant, la diversité augmente pour atteindre un pic au moment des règles.
Mais il existe de nombreuses variations à ce schéma d’évolution classique, en particulier en fonction de la composition initiale du microbiote. Ainsi, les microbiotes dominés par L. crispatus ou L. gasseri montrent une plus grande stabilité au cours du cycle avec surtout des modifications au moment des règles.
Péri-ménopause : on observe une diminution progressive de la proportion de femmes dont le microbiote vaginal est dominé par des lactobacilles. Cette tendance débute dès la pré-ménopause.
Ménopause : la proportion de femmes ayant un microbiote vaginal dominé par des lactobacilles continue de décroître avec la ménopause. La diminution de la quantité de lactobacilles s’accompagne d’une augmentation de la proportion de bactéries anaérobies. Une corrélation négative a été démontrée entre le taux de lactobacilles et le degré d’atrophie vaginale ou de sécheresse.
Menstruation
Pendant les règles sous le double effet de la brusque chute du taux d’hormones et de la présence de sang (et donc de fer) dans le vagin, l’environnement microbiotique change. D’une part, le pH augmente pour atteindre 7.2-7.4. Cette alcalinisation vaginale provoque une augmentation du nombre de bactéries anaérobies commensales et de bactéries avides de fer comme Streptococcus.
La fin des règles coïncide avec l’élévation du taux d’oestrogènes, une croissance de l’épithélium vaginal et de sa concentration en glycogène et donc à une reprise d’activité des lactobacilles. Il s’en suit une augmentation de la production d’acide lactique, une acidification du milieu vaginal et un retour cers la composition optimale du microbiote.
Grossesse
L’absence de règles et la forte imprégnation hormonale font que le microbiote de la femme enceinte est moins diversifié et plus stable que chez la femme non-enceinte. la concentration en Lactobacillus croît avec l’avancement de la grossesse. La dysbiose vaginale a de multiples conséquences sur le déroulement de la grossesse avec un risque accru d’avortement spontané, de pré-éclampsie, de rupture prématurée des membranes et de prématurité.
Post-partum
La chute brutale du taux d’ostrogènes (d’un facteur 100 à 1000 dans la 1ère semaine après l’accouchement) fait diminuer de manière spectaculaire la concentration vaginale en lactobacilles. La composition du microbiote vaginal se rapproche alors de celui de l’intestin. Le retour à une composition optimale du microbiote vaginal peut prendre plusieurs mois, jusqu’à 1 an. Les modifications du microbiote vaginal en post-partum sont une des causes de l’endométrite du post-partum.
Activité sexuelle
Des échanges entre microbiote génital masculin (peau, sperme) et le microbiote vaginal ont été démontrés. Quoi qu’il en soit, les modifications de la composition du microbiote vaginal après un rapport sexuel sont généralement transitoires car ce microbiote est résilient.
Cependant, un lien épidémiologique a été démontré entre vaginose bactérienne et partenaire sexuel récent, nombre de partenaires sexuels, homosexualité féminine et rapport anal précédent rapport vaginal. Les rapports avec des hommes circoncis diminueraient le risque de vaginose bactérienne.
Définitions
• Microbiote : le microbiote désigne l’ensemble des micro-organismes commensaux, c’est-à-dire non pathogènes (bactéries, virus, parasites, champignons) présents dans un environnement spécifique. Dans le corps humain, il existe des microbiotes spécifiques aux organes considérés.
• Microbiome : à l’origine, le microbiome désigne l’ensemble des gènes contenus dans un microbiote donné. Récemment, dans la littérature scientifique, le terme microbiome est de plus en plus utilisé pour désigner à la fois le microbiote et le génome microbien. En effet, l’impact du microbiote sur l’organisme dépend à la fois de la présence microbienne et de l’activité de ces micro-organismes.
- France MT, et al. VALENCIA: a nearest centroid classification method for vaginal microbial communities based on composition. Microbiome8, 166 (2020).
- Duflos-Cohade, Vulvo-vaginites de l’enfant pré-pubère. CNGOF, 2007.
- Bumbulienė Ž, Venclavičiūtė K, Ramašauskaite D, Arlauskiene A, Bumbul E, Drąsutiene G. Microbiological findings of vulvovaginitis in prepubertal girls. Postgrad Med J. 2014 Jan;90(1059):8-12. doi: 10.1136/postgradmedj-2013-131959. Epub 2013 Nov 4. PMID: 24191064
- Gajer P, Brotman RM, Bai G, Sakamoto J, Schütte UM, Zhong X, Koenig SS, Fu L, Ma ZS, Zhou X, Abdo Z, Forney LJ, Ravel J. Temporal dynamics of the human vaginal microbiota. Sci Transl Med. 2012 May 2;4(132):132ra52. doi: 10.1126/scitranslmed.3003605. PMID: 22553250; PMCID: PMC3722878.
- Moosa Y, Kwon D, de Oliveira T, Wong EB. Determinants of Vaginal Microbiota Composition. Front Cell Infect Microbiol. 2020 Sep 2;10:467. doi: 10.3389/fcimb.2020.00467. PMID: 32984081; PMCID: PMC7492712.
- Shen L, Zhang W, Yuan Y, Zhu W, Shang A. Vaginal microecological characteristics of women in different physiological and pathological period. Front Cell Infect Microbiol. 2022 Jul 22;12:959793. doi: 10.3389/fcimb.2022.959793. PMID: 35937699; PMCID: PMC9354832.
- Zhao F, Hu X, Ying C. Advances in Research on the Relationship between Vaginal Microbiota and Adverse Pregnancy Outcomes and Gynecological Diseases. 2023 Apr 11;11(4):991. doi: 10.3390/microorganisms11040991. PMID: 37110417; PMCID: PMC10146011.
- Moosa Y, Kwon D, de Oliveira T, Wong EB. Determinants of Vaginal Microbiota Composition. Front Cell Infect Microbiol. 2020 Sep 2;10:467. doi: 10.3389/fcimb.2020.00467. PMID: 32984081; PMCID: PMC7492712.
- Freitas AC, Chaban B, Bocking A, Rocco M, Yang S, Hill JE, et al.. The vaginal microbiome of pregnant women is less rich and diverse, with lower prevalence of Mollicutes, compared to non-pregnant women. Sci Rep.(2017) 7:9212. 10.1038/s41598-017-07790-9
- The Vaginal Microbiome During Pregnancy the Postpartum Period in a European Population. (2019). Available online at: https://www.nature.com/articles/srep08988
- Gupta P, Singh MP, Goyal K. Diversity of Vaginal Microbiome in Pregnancy: Deciphering the Obscurity. Front Public Health. 2020 Jul 24;8:326. doi: 10.3389/fpubh.2020.00326. PMID: 32793540; PMCID: PMC7393601.
- Vodstrcil LA, Twin J, Garland SM, Fairley CK, Hocking JS, Law MG, Plummer EL, Fethers KA, Chow EP, Tabrizi SN, Bradshaw CS. The influence of sexual activity on the vaginal microbiota and Gardnerella vaginalis clade diversity in young women. PLoS One. 2017 Feb 24;12(2):e0171856. doi: 10.1371/journal.pone.0171856. PMID: 28234976; PMCID: PMC5325229.
- Lewis FMT, Bernstein KT, Aral SO. Vaginal Microbiome and Its Relationship to Behavior, Sexual Health, and Sexually Transmitted Diseases. Obstet Gynecol. 2017 Apr;129(4):643-654. doi: 10.1097/AOG.0000000000001932. PMID: 28277350; PMCID: PMC6743080.
- Shardell et al., Association of Vaginal Microbiota with Signs and Symptoms of the Genitourinary Syndrome of Menopause across Reproductive Stages. J Gerontol A Biol Sci Med, 2021.
- Brotman RM, Shardell MD, Gajer P, Fadrosh D, Chang K, Silver MI, Viscidi RP, Burke AE, Ravel J, Gravitt PE. Association between the vaginal microbiota, menopause status, and signs of vulvovaginal atrophy. 2014 May;21(5):450-8. doi: 10.1097/GME.0b013e3182a4690b. PMID: 24080849; PMCID: PMC3994184.