GROSSESSE
Microbiote vaginal et grossesse
La grossesse s’accompagne d’une modification de la composition du microbiote vaginal avec :
- Une augmentation de la concentration en lactobacilles.
- Une plus grande stabilité que chez la femme non enceinte en raison de l’absence de règles)
- Et un microbiote moins diversifié1-2.
Cependant, ce microbiote évolue au cours de la grossesse avec des transitions possibles entre les différentes classes de communautés bactériennes dominées par des lactobacilles (cf classification de Ravel), mais plus rarement vers des classes non dominées par des lactobacilles (classe IV-B par exemple).
Chez des femmes accouchant à terme, la classe IV-B (signature d’une dysbiose vaginale) est rarement rencontrée.
Mais, plusieurs facteurs peuvent influencer la composition du microbiote vaginal pendant la grossesse comme l’ethnicité, ou les antécédents obstétricaux, par exemple.
Le post-partum s’accompagne d’une chute importante de la concentration en lactobacilles avec une augmentation de la concentration en bactéries anaérobies ainsi qu’une augmentation de l’α-diversité3. Ces modifications pourraient persister plusieurs mois après l’accouchement4.
Dysbiose vaginale et grossesse
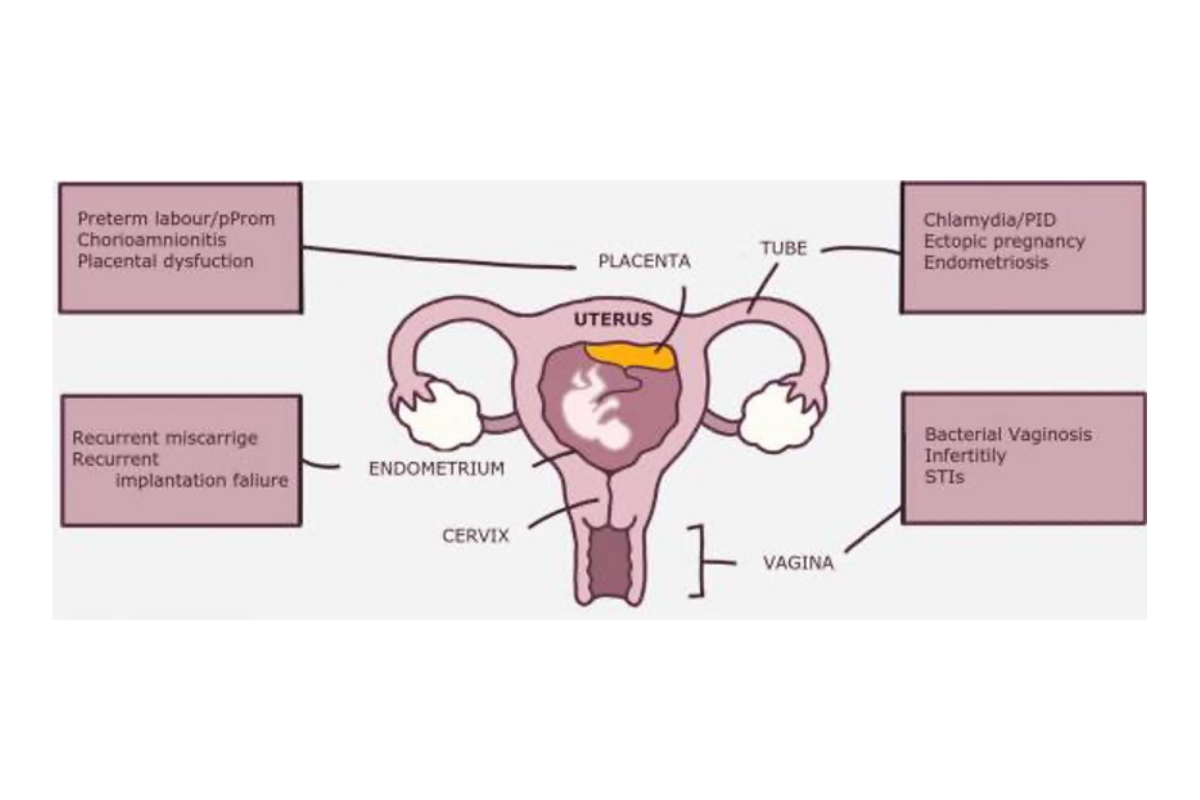
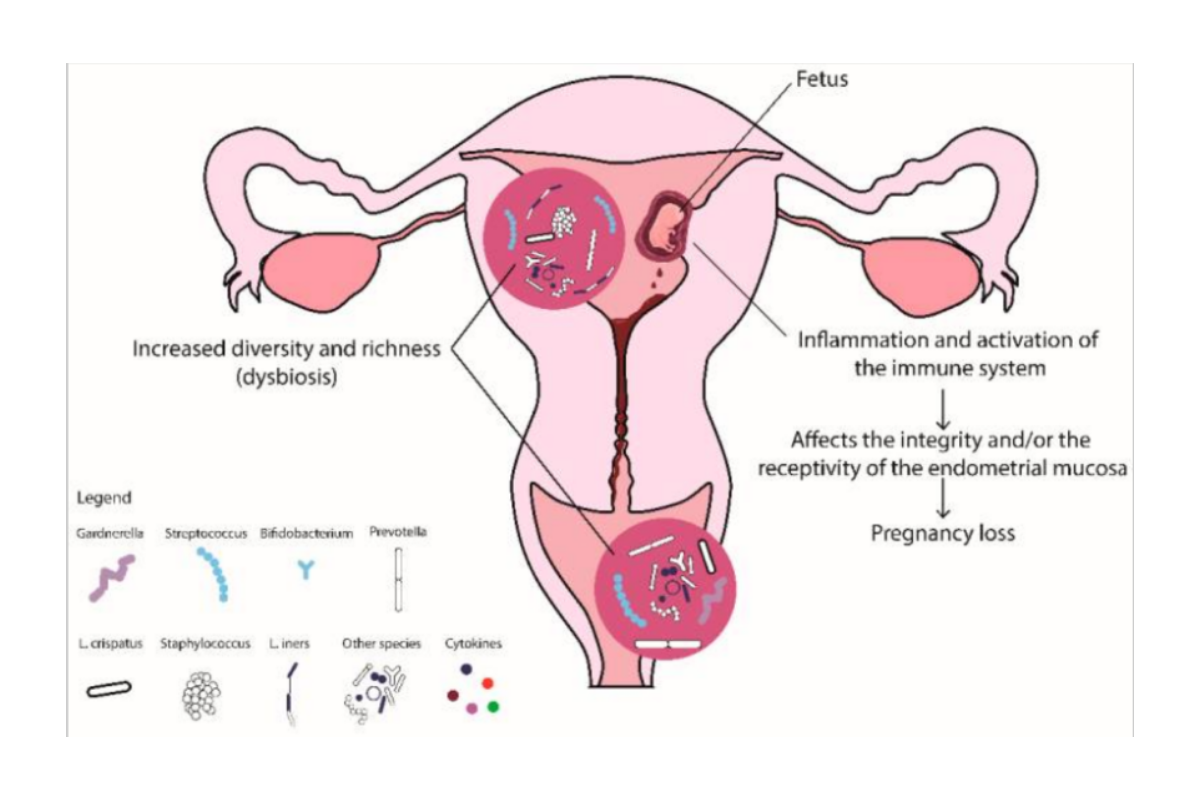
La responsabilité de la dysbiose vaginale a été démontrée dans plusieurs évènements indésirables au cours de la grossesse : grossesses ectopiques, fausse-couches précoces, rupture prématurée des membranes, prématurité, endométrite du post-partum… (cf figure 1)
Les mécanismes d’action sont divers5 :
- contamination de l’endomètre, du placenta et du fœtus par des bactéries issues du vagin
- perturbations des réponses immunitaires
- augmentation des phénomènes inflammatoires
Grossesses ectopiques
Fausses-couches spontanées
Rupture prématurée des membranes
Prématurité
Endométrite du post-partum
Grossesses ectopiques
Les anomalies tubaires (inflammation, altération des cellules ciliées, obturation) représentent entre 14 et 20% des étiologies d’infertilité féminine6. Des études7-8 a montré un lien statistiquement significatif entre une plus grande diversité du microbiote vaginal, mais surtout l’abondance de Gardnerella vaginalis et de Prevotella et les grossesses tubaires.
Fausses-couches spontanées
Une fausse-couche précoce (avant la 12ème semaine de grossesse) survient dans environ 15% des grossesses, mais son incidence augmente avec l’âge : 10% entre 20 et 24 ans vs 51% entre 40 et 44 ans9. Environ la moitié de ces fausses-couches spontanées (FCS) sont liés à une aneuploïdie ou à des aberrations chromosomiques. Parmi les autres étiologies, la responsabilité de la dysbiose vaginale a été suggérée par une étude mettant en évidence un lien statistiquement significatif entre fausse couche précoce et déplétion lactobacillaire10 . Une autre étude a montré que les avortements spontanés précoces étaient associés à un microbiote dominé par Lactobacillus iners et un microbiote plus diversifié que celui des femmes accouchant à terme11.
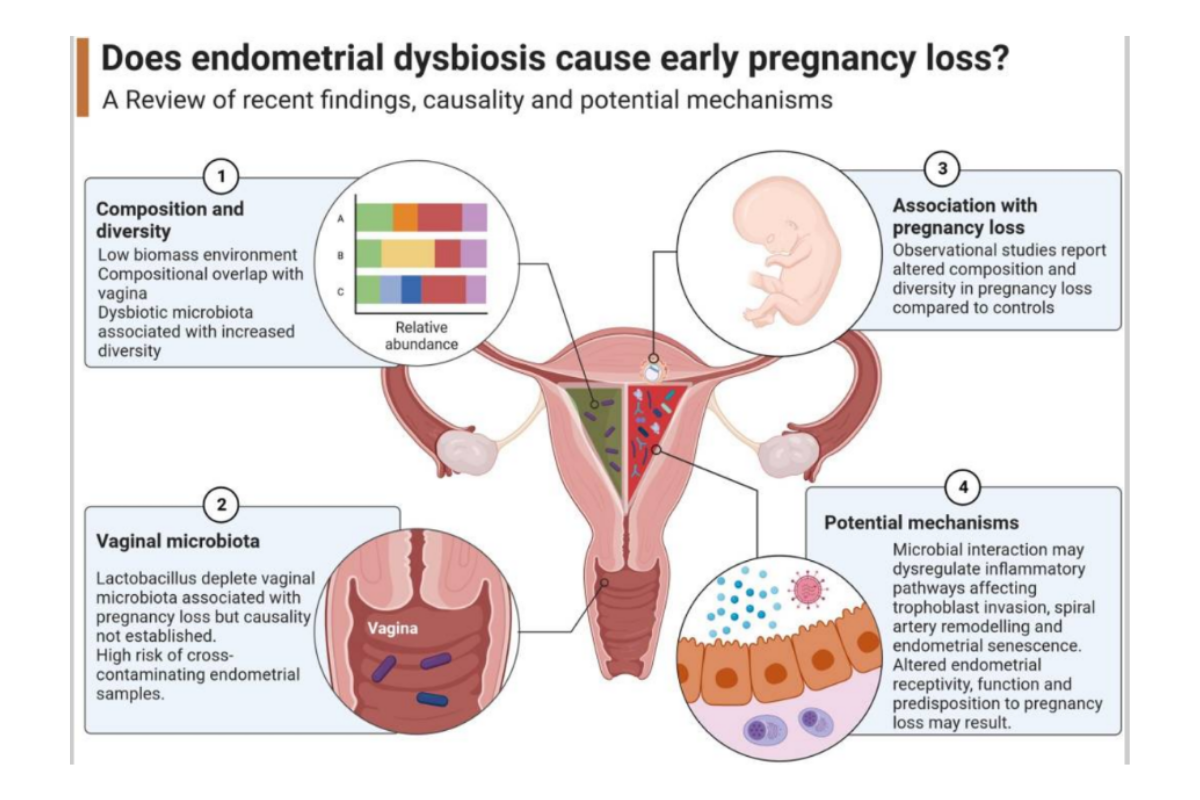
Les mécanismes de l’interaction dysbiose vaginale et FCS ne sont pas totalement élucidés12-13 : translocation bactérienne (continuum entre microbiotes vaginal et endométrial) ? dysrégulation inflammatoire conduisant à une diminution de la réceptivité endométriale ? (cf figures 2 et 3).
Rupture prématurée des membranes
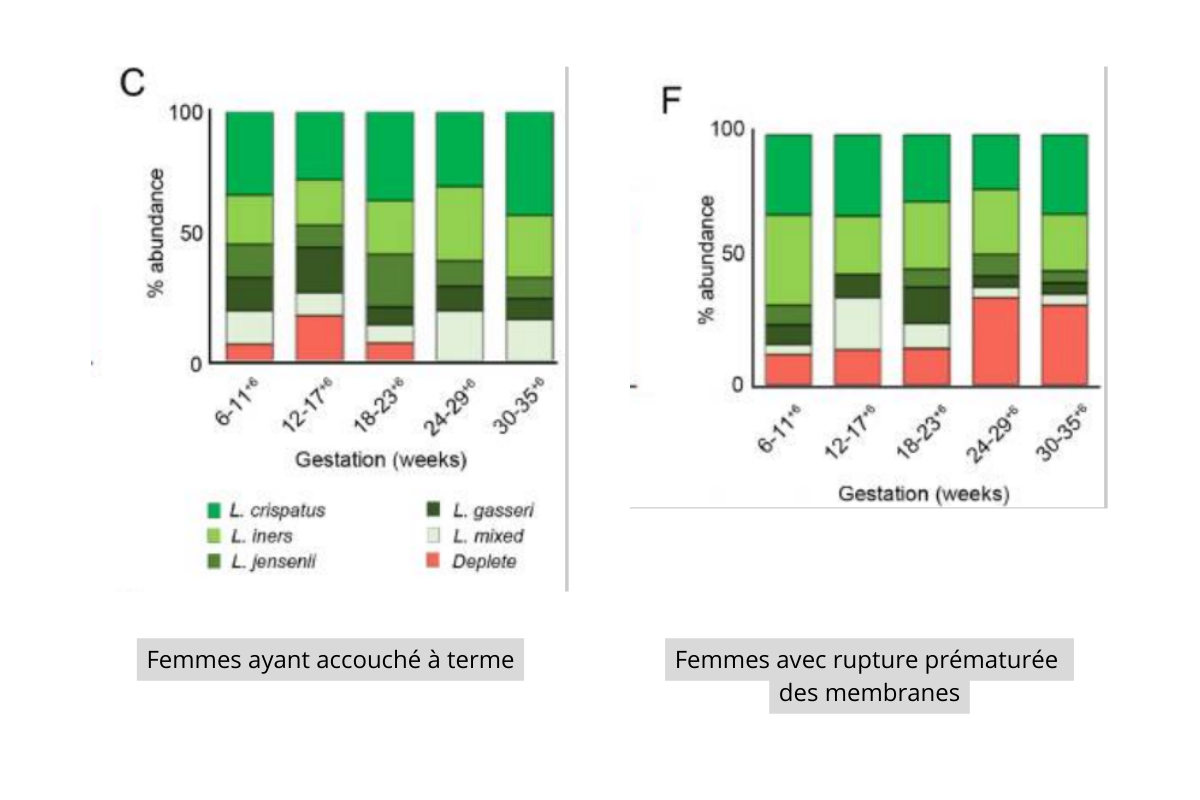
Une rupture prématurée des membranes (RPM) complique environ 3% des grossesses et précède une prématurité dans 30% des cas.14. Plusieurs études ont montré un lien entre diminution de la concentration en Lactobacillus, plus grande diversité (alpha et beta) du microbiote vaginal et RPM15-16. Une étude14 a comparé la composition du microbiote vaginal du début de grossesse (autour de 6 semaines de grossesse) chez des femmes accouchant à terme sans complications et des femmes avec RPM. Dès le début de la grossesse, une augmentation significative de la diversité microbienne est observée entre les 2 groupes (20% dans le groupe RPM vs 3% dans le groupe témoin). La diminution précoce de la concentration en lactobacilles pourrait être prédictive prédictive d’un risque de RPM (cf figure 4).
Prématurité
Le taux de prématurité est de 6.6 % en France métropolitaine mais atteint 10 % dans les départements et territoires d’outre-mer17. Plusieurs méta-analyses ont suggéré le lien entre déplétion lactobacillaire et risque de prématurité18-19. Cependant, on observe d’importantes variations sur la significativité statistique de ce lien selon les études et les localisations géographiques. Par ailleurs, une étude récente en intelligence artificielle20 montre que le facteur le plus prédictif est l’augmentation de la diversité du microbiote vaginal (plus que l’abondance de telle ou telle espèce bactérienne). Enfin, il apparaît que la dysbiose d’autres microbiotes (intestinal, oro-pharyngé, placentaire…) joue également un rôle dans le risque de prématurité21.
Endométrite du post-partum
L’endométrite du post-partum complique 1 à 6 % des grossesses selon les études22. Elle peut faire suite à une chorioamniotite et se complique souvent d’une infection du nouveau-né. La rupture prématurée des membranes mais surtout la césarienne sont des facteurs de risque d’endométrite du post-partum (risque jusqu’à 10 fois supérieur par rapport à l’accouchement voie basse23). Les bactéries les plus fréquemment retrouvées au cours de cette pathologie sont les streptocoques du groupe B (mais aussi du groupe A24), Ureaplasma urealyticum, Mycoplasma hominis, Gardnerella vaginalis, Prevotella spp…25-26.
Schémas
Fig 1 : Influence de la dysbiose vaginale sur le déroulement de la grossesse. (D’après Al-Nasiry S, Ambrosino E, Schlaepfer M, Morré SA, Wieten L, Voncken JW, Spinelli M, Mueller M, Kramer BW. The Interplay Between Reproductive Tract Microbiota and Immunological System in Human Reproduction. Front Immunol. 2020 Mar 16;11:378. doi: 10.3389/fimmu.2020.00378. PMID: 32231664; PMCID: PMC7087453.)
Fig 3 : Dysbioses et FCS : mécanismes évoqués. (D’aprèsGao X, Louwers YV, Laven JSE, Schoenmakers S. Clinical Relevance of Vaginal and Endometrial Microbiome Investigation in Women with Repeated Implantation Failure and Recurrent Pregnancy Loss. Int J Mol Sci. 2024 Jan 3;25(1):622. doi: 10.3390/ijms25010622. PMID: 38203793; PMCID: PMC10779912.)
Fig 4 : Rapport entre concentration lactobacillaire en cours de grossesse et RPM.(D’après Brown RG, Al-Memar M, Marchesi JR, Lee YS, Smith A, Chan D, Lewis H, Kindinger L, Terzidou V, Bourne T, Bennett PR, MacIntyre DA. Establishment of vaginal microbiota composition in early pregnancy and its association with subsequent preterm prelabor rupture of the fetal membranes. Transl Res. 2019 May;207:30-43. doi: 10.1016/j.trsl.2018.12.005. Epub 2018 Dec 27. PMID: 30633889; PMCID: PMC6489901.)
Bibliographie
- Romero R, Hassan SS, Gajer P, Tarca AL, Fadrosh DW, Nikita L, Galuppi M, Lamont RF, Chaemsaithong P, Miranda J, Chaiworapongsa T, Ravel J. The composition and stability of the vaginal microbiota of normal pregnant women is different from that of non-pregnant women. 2014 Feb 3;2(1):4. doi: 10.1186/2049-2618-2-4. Erratum in: Microbiome. 2014 Apr 15;2(1):10. doi: 10.1186/2049-2618-2-10. PMID: 24484853; PMCID: PMC3916806.
- Severgnini M, Morselli S, Camboni T, Ceccarani C, Salvo M, Zagonari S, Patuelli G, Pedna MF, Sambri V, Foschi C, Consolandi C, Marangoni A. Gardnerella vaginalis clades in pregnancy: New insights into the interactions with the vaginal microbiome. PLoS One. 2022 Jun 14;17(6):e0269590. doi: 10.1371/journal.pone.0269590. PMID: 35700195; PMCID: PMC9197028.
- Li KT, Li F, Jaspan H, Nyemba D, Myer L, Aldrovandi G, Joseph-Davey D. Changes in the Vaginal Microbiome During Pregnancy and the Postpartum Period in South African Women: a Longitudinal Study. Reprod Sci. 2024 Jan;31(1):275-287. doi: 10.1007/s43032-023-01351-4. Epub 2023 Sep 18. PMID: 37721699; PMCID: PMC10784382.
- DiGiulio DB, Callahan BJ, McMurdie PJ, Costello EK, Lyell DJ, Robaczewska A, Sun CL, Goltsman DS, Wong RJ, Shaw G, Stevenson DK, Holmes SP, Relman DA. Temporal and spatial variation of the human microbiota during pregnancy. Proc Natl Acad Sci U S A. 2015 Sep 1;112(35):11060-5. doi: 10.1073/pnas.1502875112. Epub 2015 Aug 17. PMID: 26283357; PMCID: PMC4568272.
- Al-Nasiry S, Ambrosino E, Schlaepfer M, Morré SA, Wieten L, Voncken JW, Spinelli M, Mueller M, Kramer BW. The Interplay Between Reproductive Tract Microbiota and Immunological System in Human Reproduction. Front Immunol. 2020 Mar 16;11:378. doi: 10.3389/fimmu.2020.00378. PMID: 32231664; PMCID: PMC7087453.
- Lindsay TJ, Vitrikas KR. Evaluation and treatment of infertility [published correction appears in Am Fam Physician. 2015 Sep 15;92 (6):437]. Am Fam Physician. 2015;91(5):308-314.
- Zhang Y, Chen S, Chen X, Zhang H, Huang X, Xue X, Guo Y, Ruan X, Liu X, Deng G, Luo S, Gao J. Association Between Vaginal Gardnerella and Tubal Pregnancy in Women With Symptomatic Early Pregnancies in China: A Nested Case-Control Study. Front Cell Infect Microbiol. 2022 Jan 17;11:761153. doi: 10.3389/fcimb.2021.761153. PMID: 35111691; PMCID: PMC8801712.
- Ruan XF, Zhang YX, Chen S, Liu XR, Zhu FF, Huang YX, Liu XJ, Luo SP, Deng GP, Gao J. Non-Lactobacillus-Dominated Vaginal Microbiota Is Associated With a Tubal Pregnancy in Symptomatic Chinese Women in the Early Stage of Pregnancy: A Nested Case-Control Study. Front Cell Infect Microbiol. 2021 Jul 7;11:659505. doi: 10.3389/fcimb.2021.659505. PMID: 34307190; PMCID: PMC8294389.
- Larsen EC, Christiansen OB, Kolte AM, Macklon N. New insights into mechanisms behind miscarriage. BMC Med. 2013 Jun 26;11:154. doi: 10.1186/1741-7015-11-154. PMID: 23803387; PMCID: PMC3699442.
- Al-Memar M, Bobdiwala S, Fourie H, Mannino R, Lee YS, Smith A, Marchesi JR, Timmerman D, Bourne T, Bennett PR, MacIntyre DA. The association between vaginal bacterial composition and miscarriage: a nested case-control study. 2020 Jan;127(2):264-274. doi: 10.1111/1471-0528.15972. Epub 2019 Oct 31. PMID: 31573753; PMCID: PMC6972675.
- Shahid M, Quinlivan JA, Peek M, Castaño-Rodríguez N, Mendz GL. Is there an association between the vaginal microbiome and first trimester miscarriage? A prospective observational study. J Obstet Gynaecol Res. 2022 Jan;48(1):119-128. doi: 10.1111/jog.15086. Epub 2021 Nov 10. PMID: 34761471.
- Odendaal J, Black N, Bennett PR, Brosens J, Quenby S, MacIntyre DA. The endometrial microbiota and early pregnancy loss. Hum Reprod. 2024 Apr 3;39(4):638-646. doi: 10.1093/humrep/dead274. PMID: 38195891; PMCID: PMC10988105.
- Gao X, Louwers YV, Laven JSE, Schoenmakers S. Clinical Relevance of Vaginal and Endometrial Microbiome Investigation in Women with Repeated Implantation Failure and Recurrent Pregnancy Loss. Int J Mol Sci. 2024 Jan 3;25(1):622. doi: 10.3390/ijms25010622. PMID: 38203793; PMCID: PMC10779912.
- Brown RG, Al-Memar M, Marchesi JR, Lee YS, Smith A, Chan D, Lewis H, Kindinger L, Terzidou V, Bourne T, Bennett PR, MacIntyre DA. Establishment of vaginal microbiota composition in early pregnancy and its association with subsequent preterm prelabor rupture of the fetal membranes. Transl Res. 2019 May;207:30-43. doi: 10.1016/j.trsl.2018.12.005. Epub 2018 Dec 27. PMID: 30633889; PMCID: PMC6489901.
- Liu L, Chen J, Chen Y, Jiang S, Xu H, Zhan H, Ren Y, Xu D, Xu Z, Chen D. Characterization of Vaginal Microbiota in Third Trimester Premature Rupture of Membranes Patients through 16S rDNA Sequencing. 2022 Jul 28;11(8):847. doi: 10.3390/pathogens11080847. PMID: 36014968; PMCID: PMC9413980.
- Mu Y, Hu A, Kan H, Li Y, He Y, Fan W, Liu H, Li Q, Zheng Y. Preterm Prelabor Rupture of Membranes Linked to Vaginal Bacteriome of Pregnant Females in the Early Second Trimester: a Case-Cohort Design. Reprod Sci. 2023 Jul;30(7):2324-2335. doi: 10.1007/s43032-022-01153-0. Epub 2023 Feb 1. PMID: 36725814; PMCID: PMC9891760.
- Indicateurs de Santé Périnatale 2022. Data DREES 28/11/2023
- Gudnadottir U, Debelius JW, Du J, Hugerth LW, Danielsson H, Schuppe-Koistinen I, Fransson E, Brusselaers N. The vaginal microbiome and the risk of preterm birth: a systematic review and network meta-analysis. Sci Rep. 2022 May 13;12(1):7926. doi: 10.1038/s41598-022-12007-9. PMID: 35562576; PMCID: PMC9106729.
- Zhou Q, Yu Y, Zhou J, Liu J, Gao J. Relationship of Lactobacillus Vaginal Microbiota Changes and the Risk of Preterm Birth: A Systematic Review and Meta-Analysis. J Womens Health (Larchmt). 2024 Feb;33(2):228-238. doi: 10.1089/jwh.2023.0393. Epub 2023 Dec 8. PMID: 38064523.
- Chakoory O, Barra V, Rochette E, Blanchon L, Sapin V, Merlin E, Pons M, Gallot D, Comtet-Marre S, Peyret P. DeepMPTB: a vaginal microbiome-based deep neural network as artificial intelligence strategy for efficient preterm birth prediction. Biomark Res. 2024 Feb 14;12(1):25. doi: 10.1186/s40364-024-00557-1. PMID: 38355595; PMCID: PMC10865581.
- Powell AM, Ali Khan FZ, Ravel J, Elovitz MA. Untangling Associations of Microbiomes of Pregnancy and Preterm Birth. Clin Perinatol. 2024 Jun;51(2):425-439. doi: 10.1016/j.clp.2024.02.009. Epub 2024 Mar 15. PMID: 38705650; PMCID: PMC11070640.
- Conde-Agudelo A, Romero R, Jung EJ, Garcia Sánchez ÁJ. Management of clinical chorioamnionitis: an evidence-based approach. Am J Obstet Gynecol. 2020 Dec;223(6):848-869. doi: 10.1016/j.ajog.2020.09.044. Epub 2020 Sep 29. PMID: 33007269; PMCID: PMC8315154.
- Haas DM, Morgan S, Contreras K, Kimball S. Vaginal preparation with antiseptic solution before cesarean section for preventing postoperative infections. Cochrane Database Syst Rev. 2020 Apr 26;4(4):CD007892. doi: 10.1002/14651858.CD007892.pub7. PMID: 32335895; PMCID: PMC7195184.
- Donders G, Greenhouse P, Donders F, Engel U, Paavonen J, Mendling W. Genital Tract GAS Infection ISIDOG Guidelines. J Clin Med. 2021 May 10;10(9):2043. doi: 10.3390/jcm10092043. PMID: 34068785; PMCID: PMC8126195.
- Jung E, Romero R, Suksai M, Gotsch F, Chaemsaithong P, Erez O, Conde-Agudelo A, Gomez-Lopez N, Berry SM, Meyyazhagan A, Yoon BH. Clinical chorioamnionitis at term: definition, pathogenesis, microbiology, diagnosis, and treatment. Am J Obstet Gynecol. 2024 Mar;230(3S):S807-S840. doi: 10.1016/j.ajog.2023.02.002. Epub 2023 Mar 21. PMID: 38233317.
- Faure K, Dessein S. Endométrites du post-partum. RPC CNGOF et SPILF ; 2019