REPRODUCTION
Les microbiomes ont un impact important dans le domaine de la reproduction, d’une part sur la fécondité féminine et la fécondité masculine, d’autre part sur les protocoles de procréation médicalement assistée.
L’impact des microbiomes sur le déroulement de la grossesse est détaillé dans l’onglet grossesse.
Microbiomes et infertilité féminine
Microbiome intestinal et infertilité féminine
Microbiome vaginal et infertilité féminine
Microbiome intestinal et infertilité féminine
Le microbiome intestinal joue un rôle important dans la régulation des hormones sexuelles.
L’axe bidirectionnel cerveau-intestin joue un rôle dans le déclenchement de la puberté par l’intermédiaire de neurotransmetteurs agissant sur la production hormonale. A contrario, les hormones sexuelles modèlent le microbiote intestinal avec des différences marquées à partir de la puberté entre hommes et femmes.
• Microbiome intestinal et Syndrome des ovaires polykystiques (SOPK) : le SOPK est une cause reconnue d’infertilite.
Une diminution de l’α diversité et des changements dans la β diversité particulièrement dans le phylum Firmicutes ont été observés au cours des SOPK. Le problème est que l’hyperandrogénie et la résistance à l’insuline caractéristiques du SOPK induisent des modifications dans la composition du microbiome intestinal ; si bien qu’il est difficile de savoir si la dysbiose précède ou est une conséquences du SOPK. Des études en pré-adolescence serait nécessaires pour préciser ce point
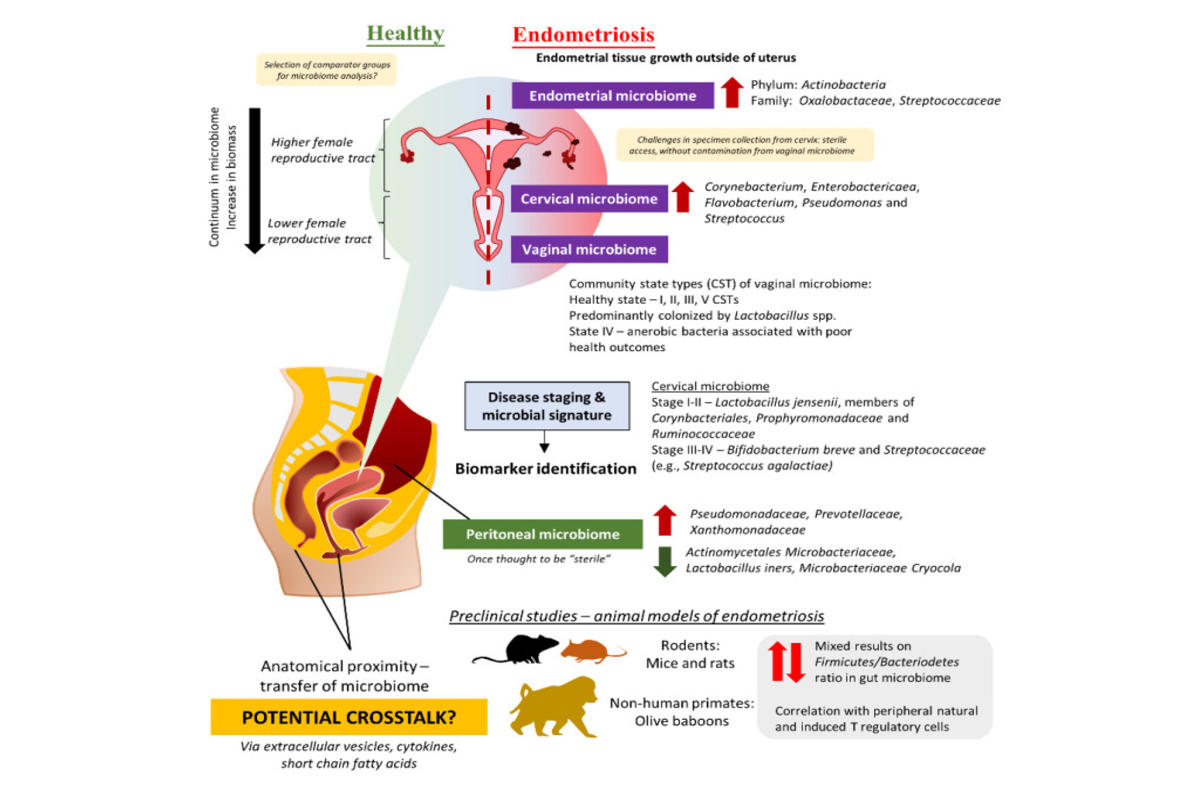
• Microbiomes et endométriose (cf Fig 1) : cette pathologie touche entre 6 et 10 % des femmes en âge de procréer. On distingue l’adénomyose (endométriose interne à l’utérus) et l’endométriose externe à l’utérus (lésions à distance). 4 stades définissent la gravité de l’endométriose (classification de l’American Society of Reproductive Medicine) :
➔ Stade I : endométriose minime
➔ Stade II : endométriose modérée
➔ Stade III : endométriose moyenne
➔ Stade IV : endométriose sévère
Des facteurs génétiques interviendraient dans environ 1 cas sur 2.
Une concordance existe entre endométriose et maladies inflammatoires intestinales accréditent la piste de la dysbiose intestinale. Les modifications observées au sein du microbiote intestinal diffèrent selon les études :
➔ Augmentation des phylum Actinobacteria, Firmicutes, Proteobacteria et Verrucomicrobia chez avec diminution des Lactobacillaceae
➔ Dominance d’E. coli et Shigella dans stades ¾
➔ Risque accru en cas d’endométriose lié à l’abondance de Bacillales, Prevotellaceae, Anaerotruncus, Olsenella
Le microbiote cervico-vaginal présente également des modifications chez les femmes porteuses d’une endométriose :
➔ Diminution de la quantité de Lactobacilles et augmentation des bactéries associées à la vaginose
➔ Diminution de la richesse et de la diversité du microbiote cervical parallèle à la sévérité de l’endométriose, à l’intensité des douleurs et au taux d’infertilité
➔ Plus grande fréquence d’HPV chez les femmes avec endométriose.
Microbiome vaginal et infertilité féminine
Le lien entre microbiote et infertilité féminine a été établi au décours d’Infections Sexuellement Transmissibles (IST). Chlamydia trachomatis, Neisseria gonorhoeae et Mycoplasma genitalium sont, en effet, responsables d’infections génitales hautes (IGH : endométrite, inflammation pelvienne, obturation tubaire). Or ces IST sont favorisées par la dysbiose vaginale.
Mais indépendamment des IST, les bactéries associées à la vaginose (BAV) peuvent être directement responsables d’IGH. Les femmes infertiles ont 3 fois plus de risque de présenter une vaginose bactérienne que les femmes fertiles.
Plusieurs mécanismes sont évoqués pour expliquer le lien entre vaginose et infertilité féminine :
➔ Les BAV induisent une activation immunologique par l’intermédiaire de la maturation de cellules dendritiques ainsi qu’une augmentation de cytokine pro-inflammatoires qui conduisent à une inflammation des tissus du tractus génital.
➔ Certaines BAV sécrétent des enzymes hydrolysantes comme des sialidases qui altèrent le mucus cervico-vaginal et augmentent d’une part l’adhésion des BAV aux muqueuses génitales (biofilms) ainsi que la perméabilité cervicale favorisant ainsi l’ascension de BAV dans le tractus génital haut.
➔ Au sein de ces BAV, Prevotella spp joue un rôle majeur dans les conséquences de la dysbiose sur la fertilité féminine.
Microbiomes et fécondité masculine
Microbiote séminal
Microbiote séminal et qualité du sperme
Microbiote intestinal et microbiote séminal
Microbiote séminal
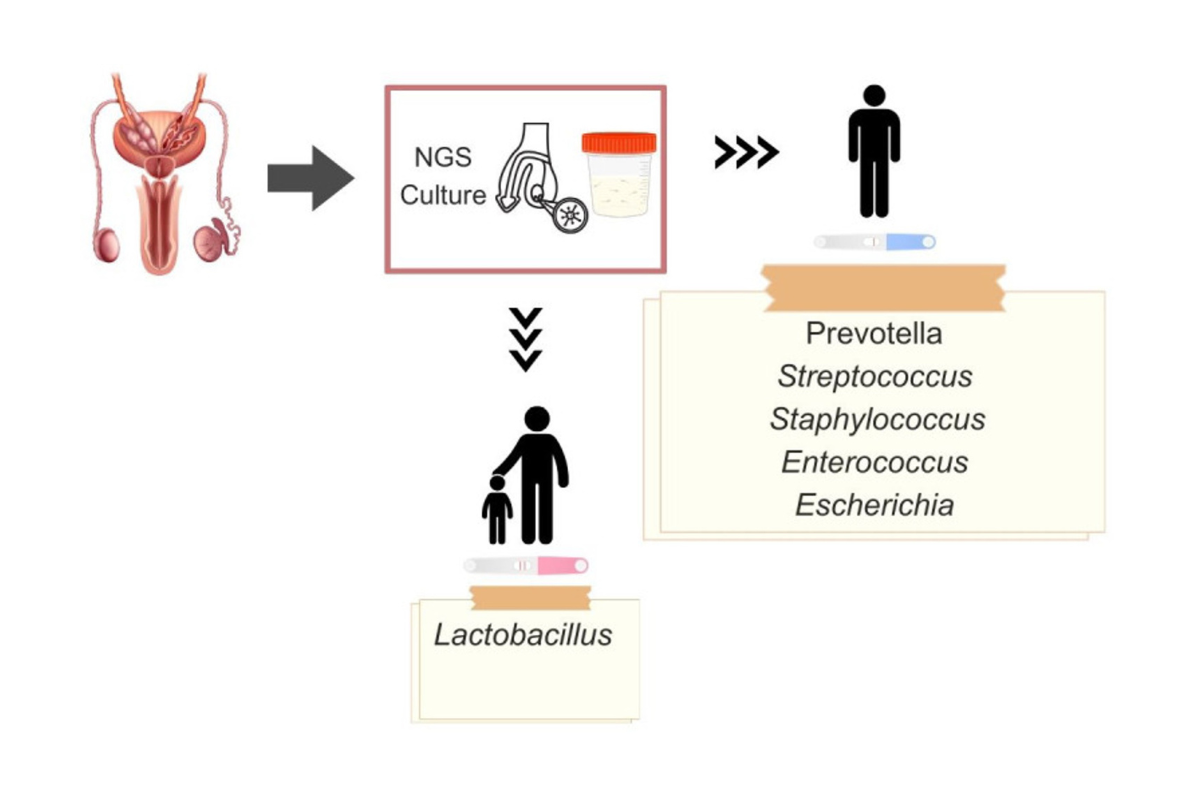
Plusieurs études montrent que le sperme possède un microbiote diversifié spécifique.
Ce microbiote est composite car il regroupe des micro-organismes des testicules, des épididymes, de la prostate, des vésicules séminales et de l’urètre. Il est également influencé par des micro-organismes des partenaires sexuels.
La composition de ce microbiote varie selon les études avec constatations :
• Il existe de grandes variations individuelles dans la composition de ce microbiote
• On peut identifier des clusters bactériens dominés des espèces particulières.
Les clusters les plus fréquents (méthodes NGS) sont dominés par Lactobacillus, par Prevotella et par Pseudomonas, le cluster dominé par lactobacillus étant plus fréquent chez les hommes avec un sperme normal.
Microbiote séminal et qualité du sperme
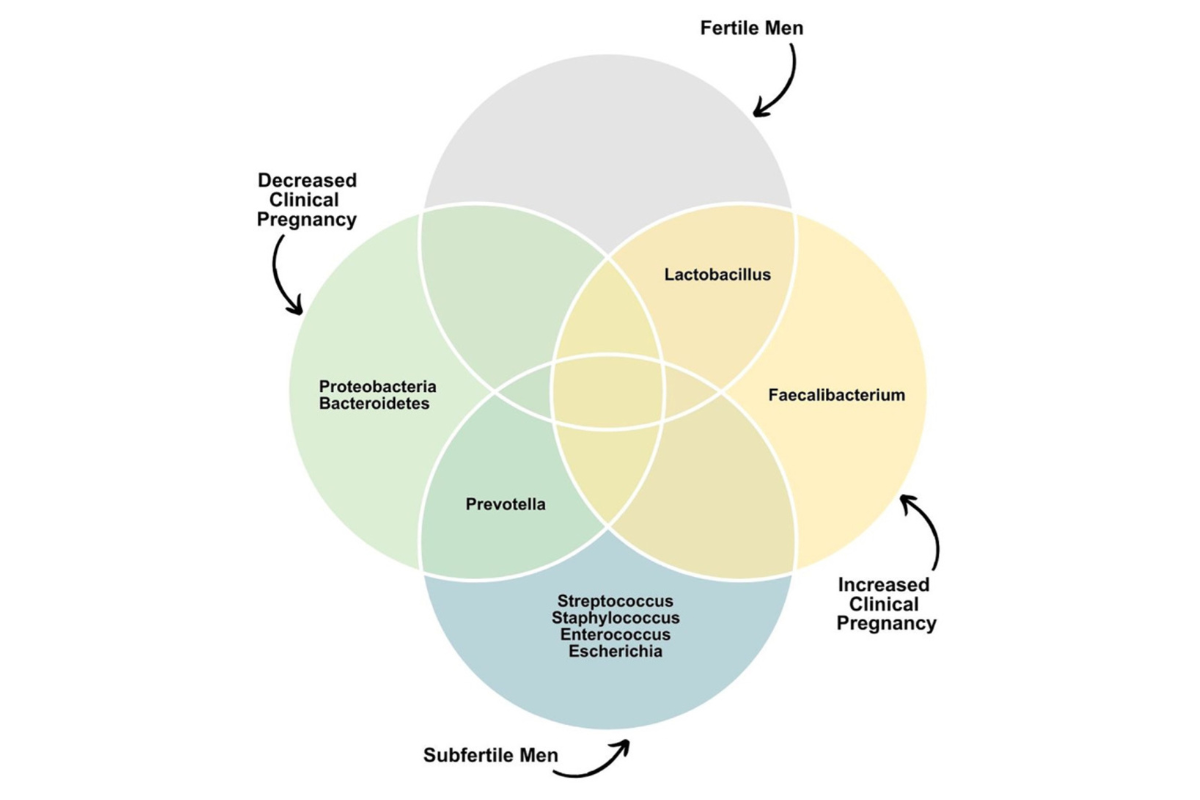
Même s’il existe encore quelques divergences dans les études, il apparaît que Lactobacillus est associé à une bonne qualité du sperme alors que d’autres bactéries (essentiellement Prevotella) sont associées à l’infertilité masculine (cf Fig 2 et Fig 3)
Microbiote intestinal et microbiote séminal
L’obésité et le surpoids impactent négativement la qualité du sperme. Les régimes riches en graisse et les régimes « occidentaux » modifient le microbiote intestinal avec une abondance relative de Bacteroides, Prevotella. Ces dernières ont un impact négatif sur la qualité du sperme.
Microbiomes et PMA
Au cours des processus de FIV, même si la qualité des embryons est optimale, les chances de grossesse dépendent grandement de la qualité de l’endomètre.
Si la composition d’un microbiome endométrial optimal est encore discutée, l’impact du microbiote cervico-vaginal sur le déroulement de la FIV est, quant à lui, bien étudié.
Impact du traitement de stimulation
Microbiote vaginal et implantation
Microbiote endométrial et implantation
Impact du traitement de stimulation
Des études ont montré que ce traitement induisait une diminution significative du taux de lactobacilles vaginaux ayant mené chez certaines femmes à l’apparition d’une vaginose bactérienne (non significatif).
Microbiote vaginal et implantation
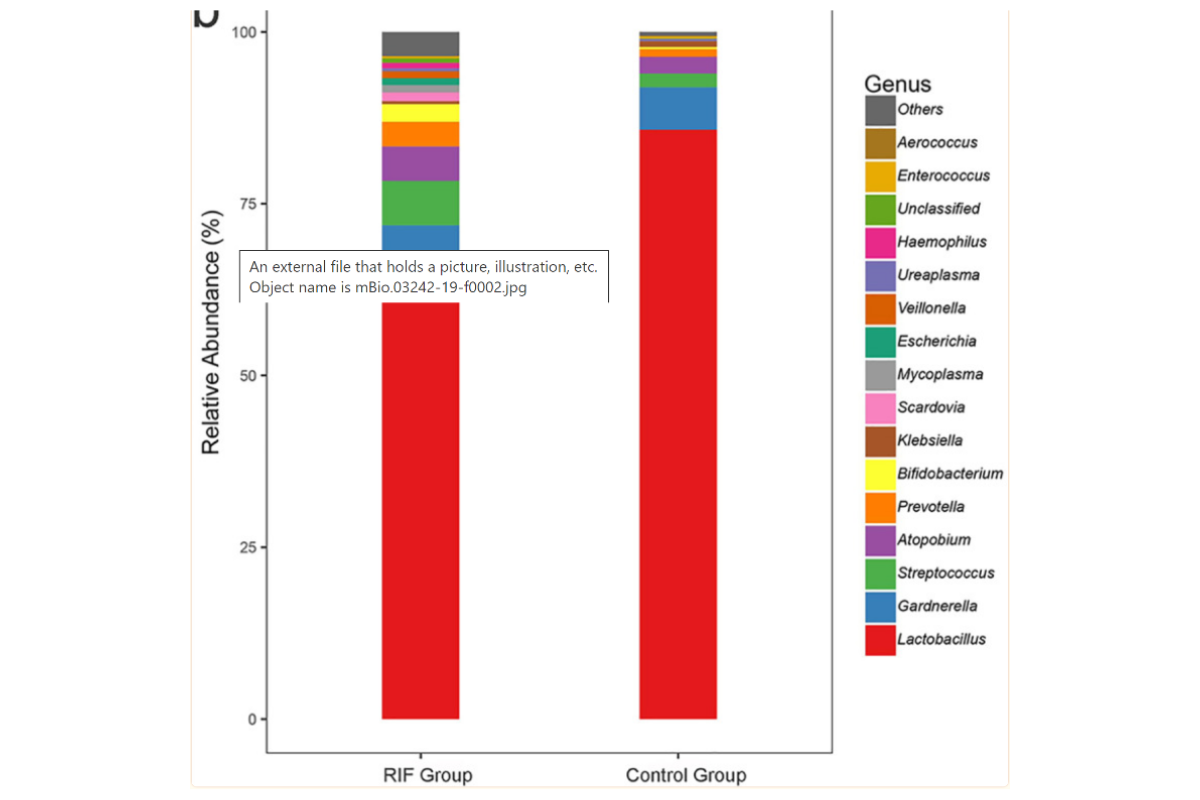
Plusieurs études ont confirmé le rôle positif de Lactobacillus crispatus sur les succès d’implantation et sur le taux de grossesses au cours des FIV. (cf Fig 4)
A contrario, Lactobacillus iners et Streptococcus étaient plus abondant chez les femmes en échec d’implantation
Microbiote endométrial et implantation
Le risque de contamination dans le recueil des échantillons endométriaux et la faible biomasse de ce microbiote expliquent l’hétérogénicité des résultats d’études.
Une étude récente montre une moins grande diversité bactérienne endométriale chez les femmes avec échec d’implantation mais pas de différence au niveau des genres bactériens dans l’endomètre.
L’échec d’implantation pourrait s’expliquer soit par la présence de pathogènes au niveau de la cavité endométriale, soit par des réactions inflammatoires suscitées par une dysbiose vaginale.
Schémas
Fig 1 : schéma des interactions microbiomes et endométriose. (D’après Ser HL, Au Yong SJ, Shafiee MN, Mokhtar NM, Ali RAR. Current Updates on the Role of Microbiome in Endometriosis: A Narrative Review. Microorganisms. 2023 Jan 31;11(2):360. doi: 10.3390/microorganisms11020360. PMID: 36838325; PMCID: PMC9962481.)
Fig 2 : Composition du microbiote séminal et fertilité masculine. D’après Neto FTL, Viana MC, Cariati F, Conforti A, Alviggi C, Esteves SC. Effect of environmental factors on seminal microbiome and impact on sperm quality. Front Endocrinol (Lausanne). 2024 Feb 22;15:1348186. doi: 10.3389/fendo.2024.1348186. PMID: 38455659; PMCID: PMC10918436.)
Fig 3 : Composition du microbiote séminal, fertilité et influence sur la grossesse. D’après Neto FTL, Viana MC, Cariati F, Conforti A, Alviggi C, Esteves SC. Effect of environmental factors on seminal microbiome and impact on sperm quality. Front Endocrinol (Lausanne). 2024 Feb 22;15:1348186. doi: 10.3389/fendo.2024.1348186. PMID: 38455659; PMCID: PMC10918436.)
Fig 4 : Mcrobiote vaginal chez des femmes avec échecs répétés d’implantation (RIF) vs femmes contrôle. (D’après Fu M, Zhang X, Liang Y, Lin S, Qian W, Fan S. Alterations in Vaginal Microbiota and Associated Metabolome in Women with Recurrent Implantation Failure. mBio. 2020 Jun 2;11(3):e03242-19. doi: 10.1128/mBio.03242-19. PMID: 32487762; PMCID: PMC7267891.)
Définitions
• Fertilité : capacité d’un homme ou d’une femme à concevoir
• Hypofertilité : diminution partielle de la fertilité nécessitant une augmentation du délai pour concevoir
• Infertilité : diminution de la capacité d’un homme, d’une femme ou d’un couple à concevoir (selon l’OMS on parle d’infertilité après 12 mois de rapports réguliers, non protégés, sans grossesse)
• Stérilité : impossibilité définitive d’avoir un enfant naturellement (azoospermie ou obturation tubaire bilatérale, par exemple)
- Microbiomes puberté, SOPK et endométriose
- Venneri MA, Franceschini E, Sciarra F, Rosato E, D’Ettorre G, Lenzi A. Human genital tracts microbiota: dysbiosis crucial for infertility. J Endocrinol Invest. 2022 Jun;45(6):1151-1160. doi: 10.1007/s40618-022-01752-3. Epub 2022 Feb 3. PMID: 35113404; PMCID: PMC9098539.
- Tsinopoulou VR, Kotanidou EP, Athanasiadis N, Sapountzi E, Bacopoulou F, Ntzani E, Galli-Tsinopoulou A, Christoforidis A. The Role of the Gut Microbiome in Youth with Polycystic Ovary Syndrome: A Systematic Review. Children (Basel). 2023 Nov 29;10(12):1872. doi: 10.3390/children10121872. PMID: 38136074; PMCID: PMC10741487.
- Leonardi M, Hicks C, El-Assaad F, El-Omar E, Condous G. Endometriosis and the microbiome: a systematic review. 2020 Jan;127(2):239-249. doi: 10.1111/1471-0528.15916. Epub 2019 Sep 19. PMID: 31454452.
- Ata B, Yildiz S, Turkgeldi E, Brocal VP, Dinleyici EC, Moya A, Urman B. The Endobiota Study: Comparison of Vaginal, Cervical and Gut Microbiota Between Women with Stage 3/4 Endometriosis and Healthy Controls. Sci Rep. 2019 Feb 18;9(1):2204. doi: 10.1038/s41598-019-39700-6. PMID: 30778155; PMCID: PMC6379373.
- Liang Y, Zeng W, Hou T, Yang H, Wu B, Pan R, Huang L. Gut microbiome and reproductive endocrine diseases: a Mendelian randomization study. Front Endocrinol (Lausanne). 2023 Aug 4;14:1164186. doi: 10.3389/fendo.2023.1164186. PMID: 37600687; PMCID: PMC10436605.
- Uzuner C, Mak J, El-Assaad F, Condous G. The bidirectional relationship between endometriosis and microbiome. Front Endocrinol (Lausanne). 2023 Mar 7;14:1110824. doi: 10.3389/fendo.2023.1110824. PMID: 36960395; PMCID: PMC10028178.
- Ser HL, Au Yong SJ, Shafiee MN, Mokhtar NM, Ali RAR. Current Updates on the Role of Microbiome in Endometriosis: A Narrative Review. 2023 Jan 31;11(2):360. doi: 10.3390/microorganisms11020360. PMID: 36838325; PMCID: PMC9962481.
Microbiome génital et infertilité féminine
- Ravel J, Moreno I, Simón C. Bacterial vaginosis and its association with infertility, endometritis, and pelvic inflammatory disease. Am J Obstet Gynecol. 2021 Mar;224(3):251-257. doi: 10.1016/j.ajog.2020.10.019. Epub 2020 Oct 19. PMID: 33091407.
- George SD, Van Gerwen OT, Dong C, Sousa LGV, Cerca N, Elnaggar JH, Taylor CM, Muzny CA. The Role of Prevotella Species in Female Genital Tract Infections. 2024 Apr 28;13(5):364. doi:10.3390/pathogens13050364. PMID: 38787215; PMCID: PMC11123741.
- Chen L, Li J, Xiao B. The role of sialidases in the pathogenesis of bacterial vaginosis and their use as a promising pharmacological target in bacterial vaginosis. Front Cell Infect Microbiol. 2024 Mar 1;14:1367233. doi: 10.3389/fcimb.2024.1367233. PMID: 38495652; PMCID: PMC10940449.
- Farahani L, Tharakan T, Yap T, Ramsay JW, Jayasena CN, Minhas S. The semen microbiome and its impact on sperm function and male fertility: A systematic review and meta-analysis. 2021 Jan;9(1):115-144. doi: 10.1111/andr.12886. Epub 2020 Oct 7. PMID: 32794312.
Microbiome séminal
- Neto FTL, Viana MC, Cariati F, Conforti A, Alviggi C, Esteves SC. Effect of environmental factors on seminal microbiome and impact on sperm quality. Front Endocrinol (Lausanne). 2024 Feb 22;15:1348186. doi: 10.3389/fendo.2024.1348186. PMID: 38455659; PMCID: PMC10918436.
- Ding N, Zhang X, Zhang XD, Jing J, Liu SS, Mu YP, et al.. Impairment of spermatogenesis and sperm motility by the high-fat diet-induced dysbiosis of gut microbes. (2020) 69(9):1608–19. doi: 10.1136/gutjnl-2019-319127
Microbiome et FIV
- van den Tweel MM, van den Munckhof EHA, van der Zanden M, Molijn A, van Lith JMM, Boers KE. The Vaginal Microbiome Changes During Various Fertility Treatments. Reprod Sci. 2024 Jun;31(6):1593-1600. doi: 10.1007/s43032-024-01484-0. Epub 2024 Feb 20. PMID: 38379070; PMCID: PMC11111482.
- Carosso A, Revelli A, Gennarelli G, Canosa S, Cosma S, Borella F, Tancredi A, Paschero C, Boatti L, Zanotto E, Sidoti F, Bottino P, Costa C, Cavallo R, Benedetto C. Controlled ovarian stimulation and progesterone supplementation affect vaginal and endometrial microbiota in IVF cycles: a pilot study. J Assist Reprod Genet. 2020 Sep;37(9):2315-2326. doi: 10.1007/s10815-020-01878-4. Epub 2020 Jul 15. PMID: 32671734; PMCID: PMC7492325.
- Väinämö S, Saqib S, Kalliala I, Kervinen K, Luiro K, Niinimäki M, Halttunen-Nieminen M, Virtanen S, Nieminen P, Salonen A, Holster T. Longitudinal analysis of vaginal microbiota during IVF fresh embryo transfer and in early pregnancy. Microbiol Spectr. 2023 Dec 12;11(6):e0165023. doi: 10.1128/spectrum.01650-23. Epub 2023 Oct 26. PMID: 37882794; PMCID: PMC10715154.
- Fu M, Zhang X, Liang Y, Lin S, Qian W, Fan S. Alterations in Vaginal Microbiota and Associated Metabolome in Women with Recurrent Implantation Failure. mBio. 2020 Jun 2;11(3):e03242-19. doi: 10.1128/mBio.03242-19. PMID: 32487762; PMCID: PMC7267891.
- Reschini M, Benaglia L, Ceriotti F, Borroni R, Ferrari S, Castiglioni M, Guarneri D, Porcaro L, Vigano’ P, Somigliana E, Uceda Renteria S. Endometrial microbiome: sampling, assessment, and possible impact on embryo implantation. Sci Rep. 2022 May 19;12(1):8467. doi: 10.1038/s41598-022-12095-7. PMID: 35589752; PMCID: PMC9120179.
- Gao X, Louwers YV, Laven JSE, Schoenmakers S. Clinical Relevance of Vaginal and Endometrial Microbiome Investigation in Women with Repeated Implantation Failure and Recurrent Pregnancy Loss. Int J Mol Sci. 2024 Jan 3;25(1):622. doi: 10.3390/ijms25010622. PMID: 38203793; PMCID: PMC10779912.