UROLOGIE
Des populations microbiennes dans les urines ont été décrites pour la première fois il y a une dizaine d’années. Grâce aux techniques moléculaires, on sait maintenant que l’urine de l’homme et de la femme héberge un microbiome appelé urobiome. La composition de l’urobiome fait encore l’objet de débats et semble varier (surtout chez l’homme) selon la méthode de recueil de l’urine (milieu de jet mictionnel, sondage transurétral, cathétérisme vésical sus-pubien), les techniques biologiques (culture bactérienne, biologie moléculaire y compris culturomique), l’âge et la consommation antibiotique.
Composition de l’urobiome
Urobiome et E. coli
L’axe intestin-vessie
Urobiome et infections urinaires
Urobiome et autres pathologies génito-urinaires
Composition de l’urobiome
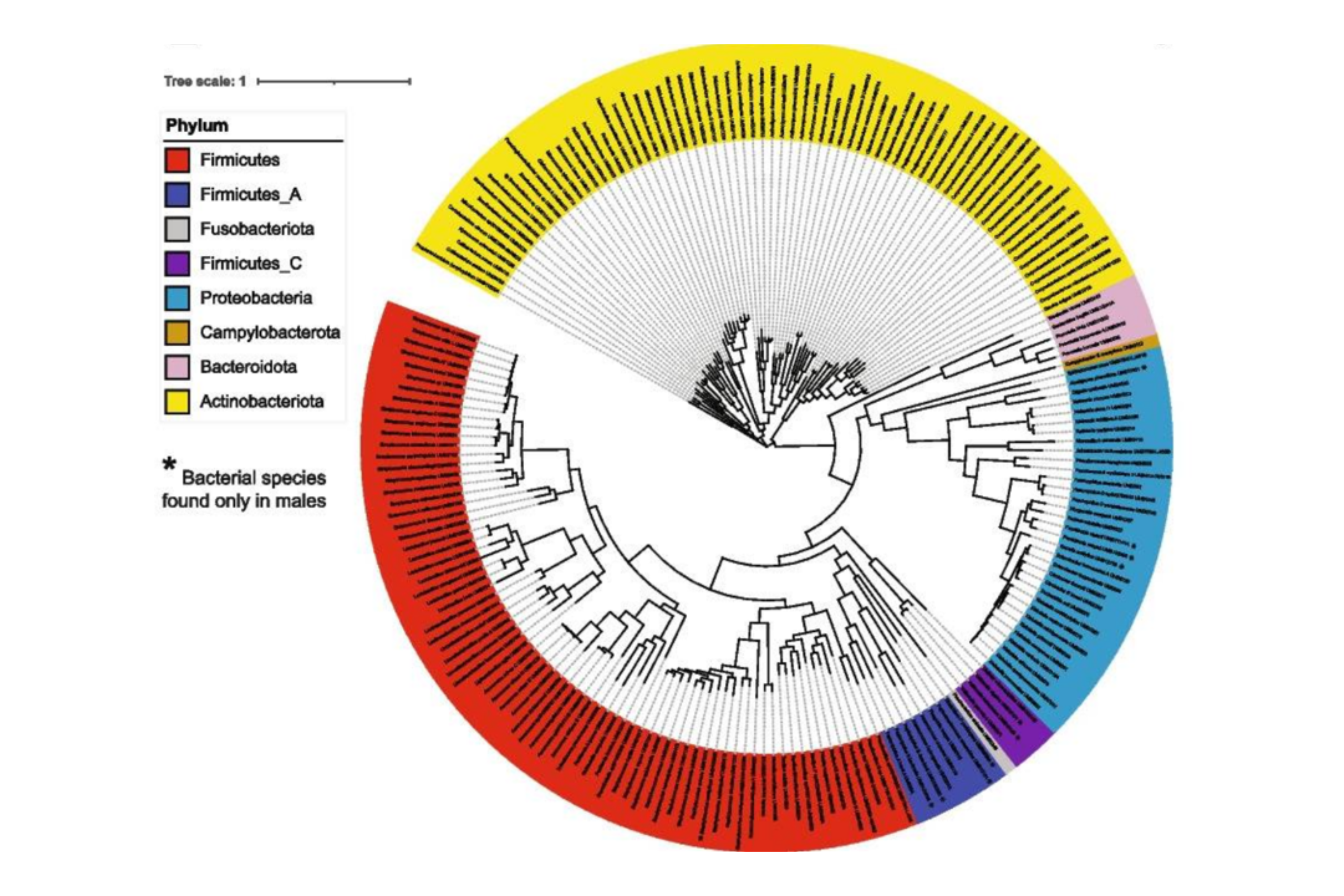
Étudiés en culturomique et séquençage 16S rRNA, les microbiomes urinaires masculin et féminin sont identiques au niveau phyla avec une majorité de Firmicutes. Les autres phyla montrent également des différences mineures selon le sexe : Actinobacteriota moins abondants chez l’homme, Bacteroidetes et Proteobacteria moins abondants chez la femme (cf Fig 1).
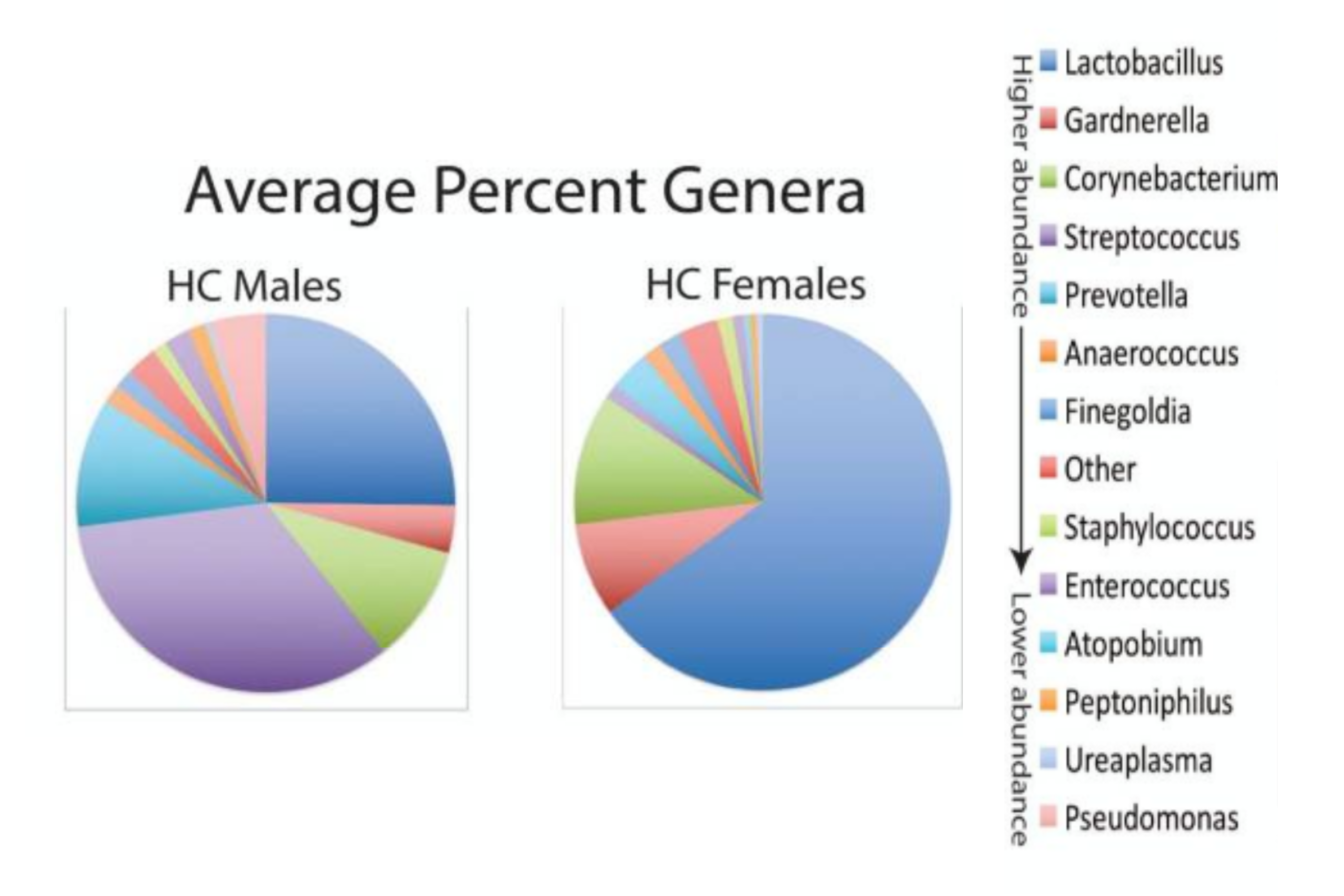
Chez la femme «saine», quelle que soit la méthode de recueil des urines, on observe une dominance de Lactobacillus. Parmi ces Lactobacillus, Lactobacillus crispatus semble avoir un effet protecteur vis-à-vis de la colonisation par des uropathogènes. Les autres espèces bactériennes rapportées dans les urines de femmes saines sont Gardnerella, Corynebacterium, Prevotella…
Chez l’homme «sain», on observe une dominance de Streptococcus. Les autres espèces rapportées sont Lactobacillus (en moindre quantité que chez la femme), Corynebacterium… (cf Fig 2).
Chez l’homme comme chez la femme, l’urobiome présente une faible biomasse.
Au total, l’urobiome paraît comme un microbiome distinct, bien qu’il partage un certain nombre d’espèces bactériennes avec l’intestin et le vagin.
Urobiome et E. coli
E-coli (UPEC) fait partie des uropathogènes les plus fréquemment en cause au cours des infections urinaires. Ces bactéries sont retrouvées dans l’urobiome d’hommes et de femmes asymptomatiques et, bien entendu chez des sujets symptomatiques. Ces E. coli urinaires appartiennent majoritairement à un groupe phylogénique particulier (phylogroupe B2) moins abondant dans l’intestin que d’autres groupes phylogéniques. Ce groupe phylogénique d’E. coli serait donc plus apte à coloniser la niche vésicale que d’autres groupes phylogéniques.
L’axe intestin-vessie
Un lien existe entre diverses pathologies vésicales (hyperactivité vésicale, cystite interstitielle, prostatite chronique, douleurs pelviennes chroniques…) et syndrome du côlon irritable ainsi que stress chronique. Au-delà de l’intestin, il existe bien un axe complexe bidirectionnel vessie-intestin-cerveau.
Plusieurs mécanismes peuvent être en cause :
• Translocation bactérienne soit par voie périnéale en raison de la proximité anatomique de l’anus et du méat urinaire chez la femme, soit par voie systémique en cas de perméabilité de la paroi intestinale
• Translocation systémique de métabolites bactériens : acides gras à chaîne courte, cytokines pro-inflammatoires et métabolites agissant sur l’immunité …
Il ne faut pas ignorer également des modifications de l’environnement urétro-vésical qui pourraient favoriser la croissance et l’agressivité d’uro-pathogènes. Chez la femme, le microbiome vaginal joue un rôle dans la colonisation vésicale par des uro-pathogènes : en cas de dysbiose vaginale, le microbiome vaginal ne joue plus son rôle de « sas » entre le rectum et la vessie facilitant ainsi l’ascension bactérienne via l’urètre. Il a même été démontré que des traitements de colite pseudomembraneuses par transplantation de microbiote fécal pouvait réduire certaines infections urinaires.
Urobiome et infections urinaires
Les infections urinaires (IU) sont 8 fois plus fréquentes chez la femme que chez l’homme.
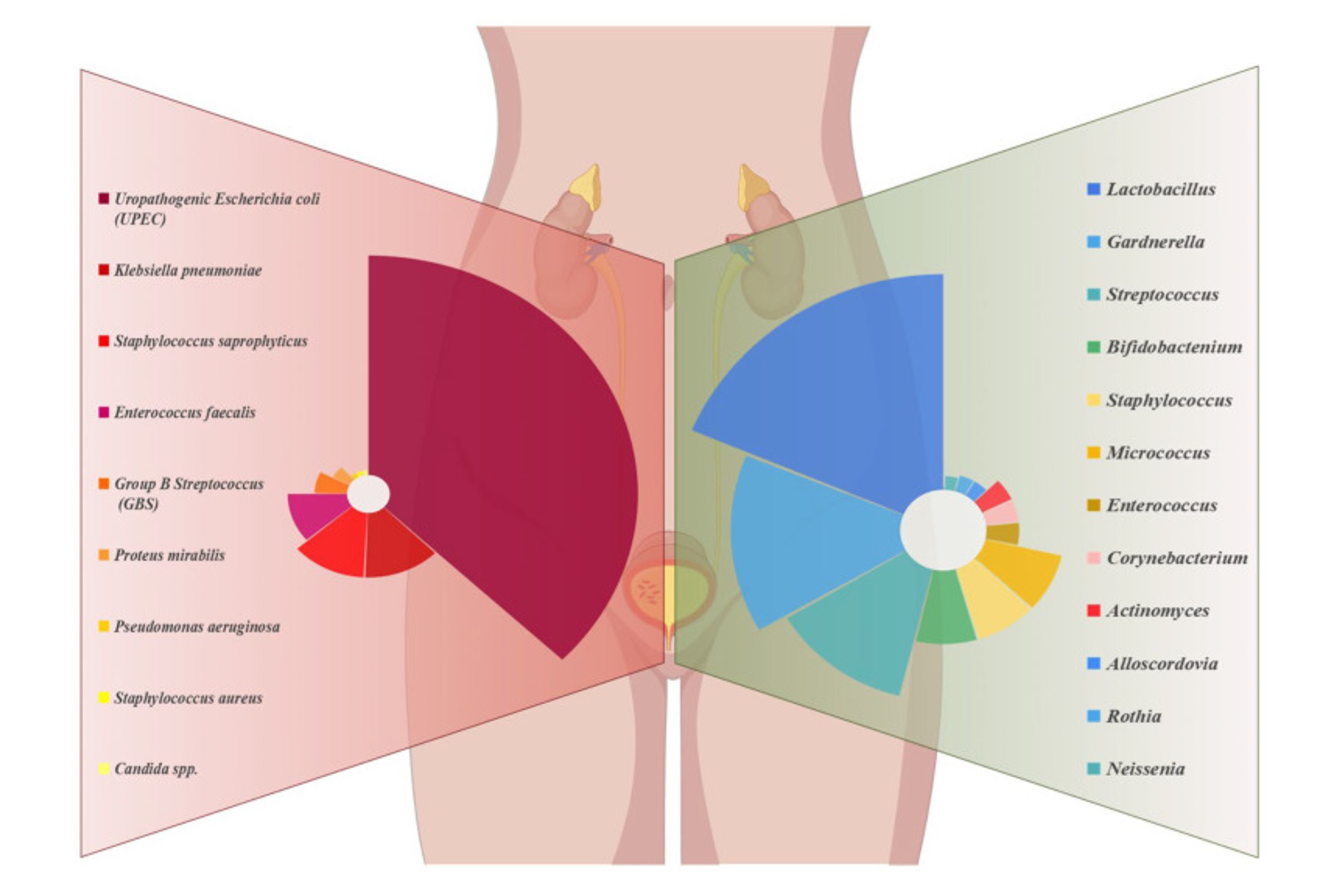
➔ Chez la femme, on distingue la cystite simple non compliquée de la cystite à risque de complication (sur terrain favorisant comme la grossesse, des pathologies associées ou l’âge…) et de la cystite récidivante (plus de 4 épisodes par an). Les bactéries les plus souvent en cause sont majoritairement les souches d’Escherichia coli uropathogènes (UPEC) suivies par Klebsiella pneumoniae, Staphylococcus saprophyticus, Enteroccus faecalis et Proteus mirabilis (cf Fig 3).
La prise en charge de ces infections récidivantes doit tenir compte du risque de dsybiose intestinale et/ou vaginale.
➔ Chez l’homme, l’urobiome est également impliqué dans les prostatites chroniques et les douleurs pelviennes chroniques. Ces pathologies impliqueraient aussi le microbiote séminal avec, en particulier, une diminution de la concentration en lactobacilles.
Urobiome et autres pathologies génito-urinaires
➔ Urobiome et incontinence urinaire
L’incontinence urinaire féminine (IUF) (perte involontaire des urines en dehors des mictions) touche environ 30 % des femmes et augmente avec l’âge. Plusieurs causes sont identifiées : hypermobilité urétrale, altération du sphincter urinaire, hyperactivité et hyper sensibilité vésicales…Des modifications des microbiotes urinaire et vaginal ont également été associées à l’IUF chez les femmes en post-partum et chez les femmes ménopausées avec une diminution des lactobacilles et une augmentation de la concentration de bactéries associées à la vaginose. Cependant, si la dysbiose urinaire et/ou vaginale est avérée chez les femmes avec IUF, les résultats sont parfois discordants au niveau des genres bactériens selon les études.
➔ Microbiomes et calculs urinaires
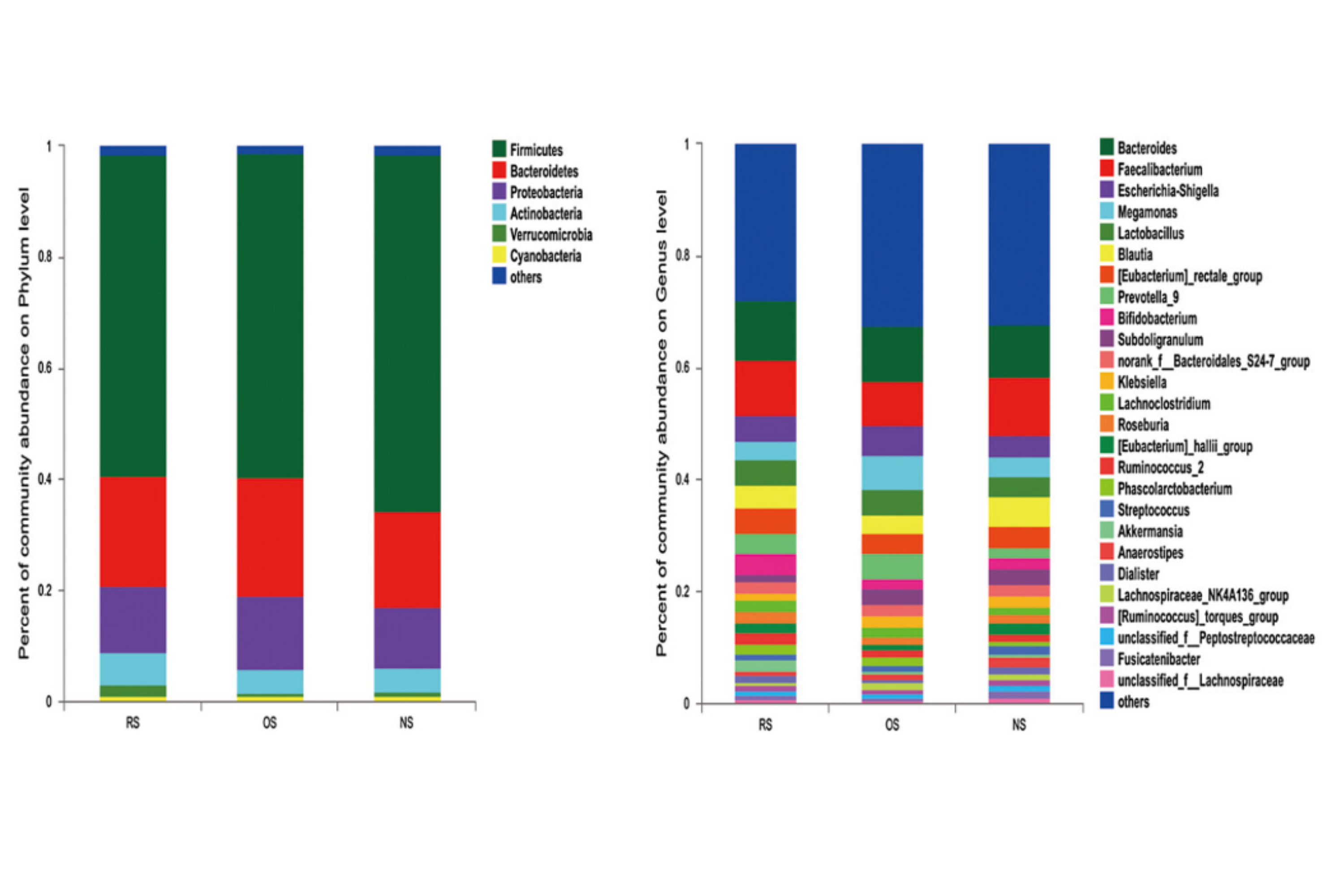
La majorité des calculs urinaires est constituée d’oxalates de calcium, plus rarement d’acide urique. Le microbiote intestinal et l’urobiome montrent des modifications dans leur composition entre sujets lithiasiques et témoins : augmentation des bactéries du genre Bacteroides et diminution des bactéries du genre Prevotella dans l’intestin des sujets lithiasiques (cf Fig 4).
Une autre étude a montré la présence plus abondante de bactéries productrices d’acides gras à chaîne courte (Blautia, Anaerostipes, Coprociccus, Fusobacterium…) chez les sujets sains par rapports aux sujets lithiasiques. Or certains de ces acides (acétate, pyruvate, butyrate) ont montré une action anti-oxalate rénale chez l’animal.
Le microbiote intestinal pourrait également intervenir via sa propriété de métaboliser les hormones sexuelles. En effet les androgènes favorisent la formation de lithiases d’oxalate alors que les oestrogènes diminuent le risque.
Dans les urines, plusieurs bactéries (Proteus mirabilis, Klebsiella pneumonia, Staphylococcus aureus, Pseudomonas aeruginosa, Providentia stuartii, Serratia…) sont productrices d’uréase qui alcalinise les urines et favorise la formation de cristaux urinaires.
➔ Urobiome et cancers uro-génitaux
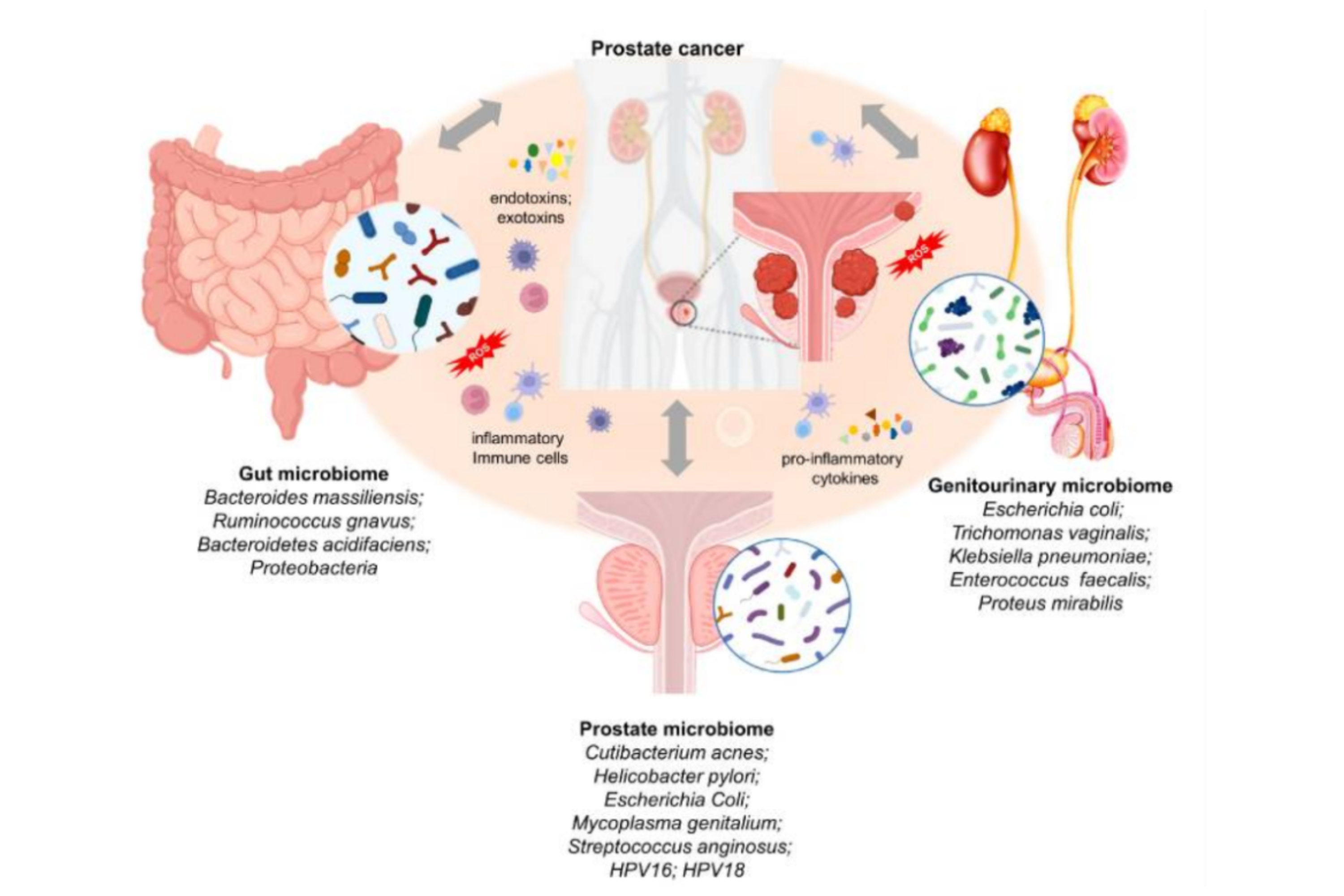
• Cancer prostatique : les mécanismes du lien entre microbiomes et cancer de la prostate sont encore imprécis mais il a été observé une implication de plusieurs microbiotes (intestinal, génito-urinaire et prostatique) dans le cancer prostatique (cf Fig 5). Par ailleurs, le lien démontré entre obésité et cancer de la prostate est en faveur d’un rapport entre dysbiose intestinale et cancer prostatique.
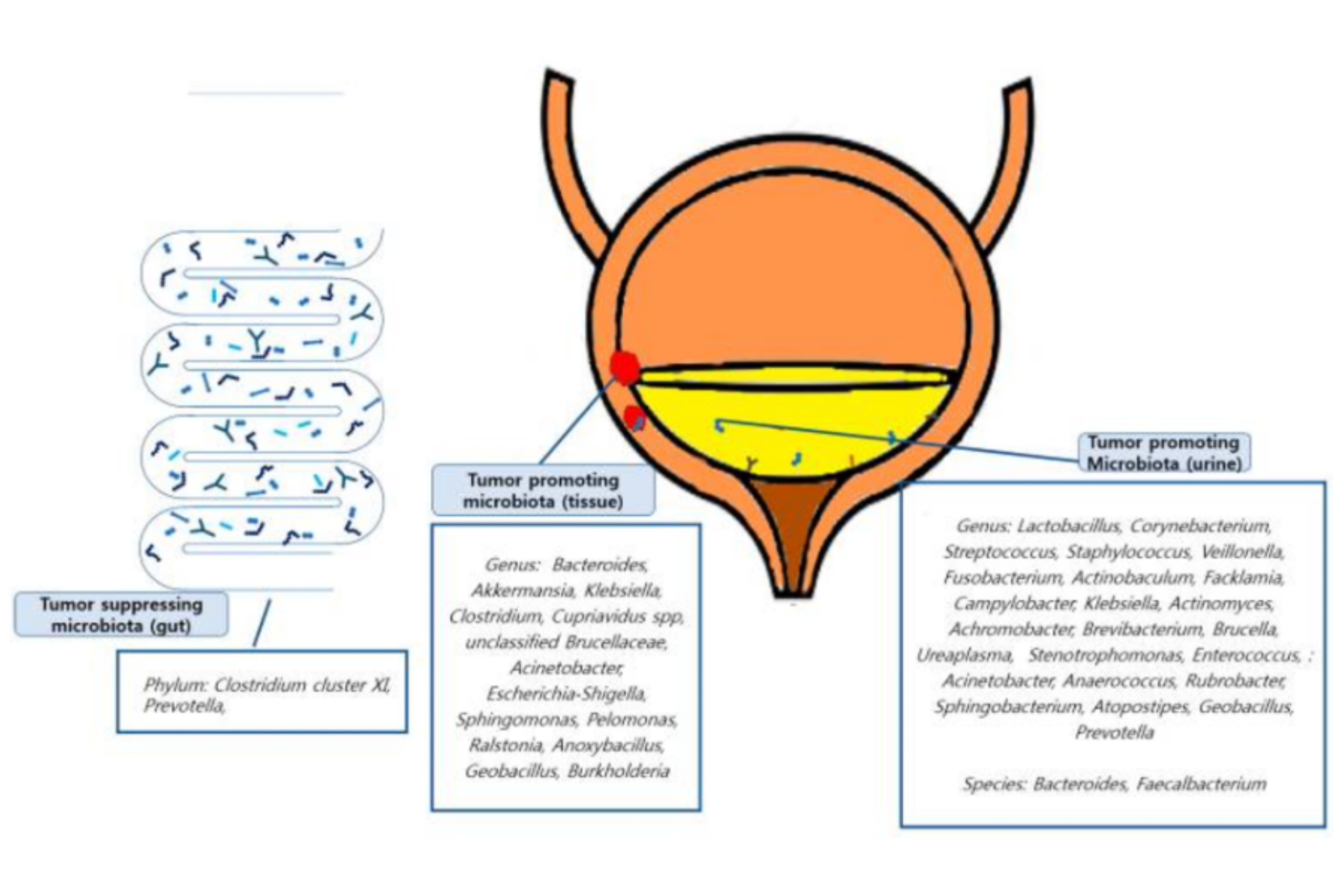
• Cancer de la vessie : l’hétérogénicité des études sur microbiomes et cancer de la vessie rend difficile toute conclusion robuste sur l’implication de telle ou telle bactérie dans la survenue de ce cancer. La figure 6 résume les données actuelles.
• Cancer du rein : la concentration intestinale de Ruminococcustorques et de Erysipelatoclostridium pourrait être liée à une augmentation du risque de cancer du rein. Plusieurs mécanismes physiopathologiques sont évoqués pour expliquer le rapport entre dysbiose intestinale et carcinome rénal :
– Action directe de bactéries pathogènes qui créent une inflammation tissulaire avec sécrétion de dérivés réactifs en oxygène (radicaux libres, peroxydes…) qui favorisent la carcinogénèse
– Action indirecte de bactéries qui limitent les réactions immunitaires susceptibles de bloquer la prolifération tumorale
– Production par des bactéries pathogènes et passage systémique de métabolites microbiens avec altération des barrières cellulaires
Schémas
Fig 1 : Phyla bactériens de l’urobiome hommes et femmes (d’après Du J, Khemmani M, Halverson T, Ene A, Limeira R, Tinawi L, Hochstedler-Kramer BR, Noronha MF, Putonti C, Wolfe AJ. Cataloging the phylogenetic diversity of human bladder bacterial isolates. Genome Biol. 2024 Mar 21;25(1):75. doi: 10.1186/s13059-024-03216-8. PMID: 38515176; PMCID: PMC10958879.)
Fig 2 : Composition de l’urobiome chez la femme et l’homme en l’absence de pathologie urinaire (d’après Modena B. D., Milam R., Harrison F., Cheeseman J. A., Abecassis M. M., Friedewald J. J., et al.. (2017). Changes in Urinary Microbiome Populations Correlate in Kidney Transplants With Interstitial Fibrosis and Tubular Atrophy Documented in Early Surveillance Biopsies. Am. J. Transplant. 17 (3), 712–723. 10.1111/ajt.14038)
Fig 3 : Comparaison entre microbiote urétrale femme saine (droite) et femme avec infection urinaire (gauche). D’après Zheng H, Wang C, Yu X, Zheng W, An Y, Zhang J, Zhang Y, Wang G, Qi M, Lin H, Wang F. The Role of Metabolomics and Microbiology in Urinary Tract Infection. Int J Mol Sci. 2024 Mar 8;25(6):3134. doi: 10.3390/ijms25063134. PMID: 38542107; PMCID: PMC10969911.)
Fig 4 : Différence de compsition du microbiote intestinal entre sujets saisn (NS), sujets avec lithiases rénales récidivantes (KS) et lithiase rénale peu récidivante (OS). D’après : Liu Y, Jin X, Hong HG, et al The relationship between gut microbiota and short chain fatty acids in the renal calcium oxalate stones disease. FASEB J. 2020 Aug;34(8):11200-11214. doi: 10.1096/fj.202000786R. Epub 2020 Jul 9. PMID: 32645241.
Fig 5 : implications de divers microbiomes dans le cancer prostatique. (D’après : Kustrimovic N, Bombelli R, Baci D, Mortara L. Microbiome and Prostate Cancer: A Novel Target for Prevention and Treatment. Int J Mol Sci. 2023 Jan 12;24(2):1511. doi: 10.3390/ijms24021511. PMID: 36675055; PMCID: PMC9860633.)
Bibliographie
- La revue des Microbiotes n° 27 à télécharger sur le site : https://www.larevuedesmicrobiotes.fr/
Urobiome et infections urinaires
- Du J, Khemmani M, Halverson T, Ene A, Limeira R, Tinawi L, Hochstedler-Kramer BR, Noronha MF, Putonti C, Wolfe AJ. Cataloging the phylogenetic diversity of human bladder bacterial isolates. Genome Biol. 2024 Mar 21;25(1):75. doi: 10.1186/s13059-024-03216-8. PMID: 38515176; PMCID: PMC10958879.
- Modena B. D., Milam R., Harrison F., Cheeseman J. A., Abecassis M. M., Friedewald J. J., et al.. (2017). Changes in Urinary Microbiome Populations Correlate in Kidney Transplants With Interstitial Fibrosis and Tubular Atrophy Documented in Early Surveillance Biopsies. J. Transplant.17 (3), 712–723. 10.1111/ajt.14038
- Roth RS, Liden M, Huttner A. The urobiome in men and women: a clinical review. Clin Microbiol Infect. 2023 Oct;29(10):1242-1248. doi: 10.1016/j.cmi.2022.08.010. Epub 2022 Aug 24. PMID: 36028087.
- Zheng H, Wang C, Yu X, Zheng W, An Y, Zhang J, Zhang Y, Wang G, Qi M, Lin H, Wang F. The Role of Metabolomics and Microbiology in Urinary Tract Infection. Int J Mol Sci. 2024 Mar 8;25(6):3134. doi: 10.3390/ijms25063134. PMID: 38542107; PMCID: PMC10969911.
Urobiome et incontinence urinaire
- Govender Y, Gabriel I, Minassian V, Fichorova R. The Current Evidence on the Association Between the Urinary Microbiome and Urinary Incontinence in Women. Front Cell Infect Microbiol. 2019 May 1;9:133. doi: 10.3389/fcimb.2019.00133. PMID: 31119104; PMCID: PMC6504689.
- Zhang M, Zhou Y, Yao S, Zhao Y, Batool SS, Huang J, Jiang L, Yan D, Yan W, Yu Z. Effect of stress urinary incontinence on vaginal microbial communities. BMC Microbiol. 2024 Apr 4;24(1):112. doi: 10.1186/s12866-024-03237-0. PMID: 38575862; PMCID: PMC10993610.
Microbiomes et lithiase rénale
- Wang Z, Zhang Y, Zhang J, Deng Q, Liang H. Recent advances on the mechanisms of kidney stone formation (Review). Int J Mol Med. 2021 Aug;48(2):149. doi: 10.3892/ijmm.2021.4982. Epub 2021 Jun 16. PMID: 34132361; PMCID: PMC8208620.
- Liu Y, Jin X, Hong HG, Xiang L, Jiang Q, Ma Y, Chen Z, Cheng L, Jian Z, Wei Z, Ai J, Qi S, Sun Q, Li H, Li Y, Wang K. The relationship between gut microbiota and short chain fatty acids in the renal calcium oxalate stones disease. FASEB J. 2020 Aug;34(8):11200-11214. doi: 10.1096/fj.202000786R. Epub 2020 Jul 9. PMID: 32645241.
Microbiomes et cancers
- Kustrimovic N, Bombelli R, Baci D, Mortara L. Microbiome and Prostate Cancer: A Novel Target for Prevention and Treatment. Int J Mol Sci. 2023 Jan 12;24(2):1511. doi: 10.3390/ijms24021511. PMID: 36675055; PMCID: PMC9860633.
- Kim SJ, Park M, Choi A, Yoo S. Microbiome and Prostate Cancer: Emerging Diagnostic and Therapeutic Opportunities. Pharmaceuticals (Basel). 2024 Jan 13;17(1):112. doi: 10.3390/ph17010112. PMID: 38256945; PMCID: PMC10819128.
- Gwon YN, Park JJ, Lee KS, Lee KH, Kim TH, Kim JH. Microbiome in Bladder Cancer: A Systematic Review. Diagnostics (Basel). 2022 Dec 28;13(1):84. doi: 10.3390/diagnostics13010084. PMID: 36611376; PMCID: PMC9818914.
- Mingdong W, Xiang G, Yongjun Q, Mingshuai W, Hao P. Causal associations between gut microbiota and urological tumors: a two-sample mendelian randomization study. BMC Cancer. 2023 Sep 11;23(1):854. doi: 10.1186/s12885-023-11383-3. PMID: 37697271; PMCID: PMC10496293.
- Luo M, Cai J, Luo S, Hong X, Xu L, Lin H, Chen X, Fu W. Causal effects of gut microbiota on the risk of chronic kidney disease: a Mendelian randomization study. Front Cell Infect Microbiol. 2023 Mar 31;13:1142140. doi: 10.3389/fcimb.2023.1142140. PMID: 37065213; PMCID: PMC10102584.
- Yang JW, Wan S, Li KP, Chen SY, Yang L. Gut and urinary microbiota: the causes and potential treatment measures of renal cell carcinoma. Front Immunol. 2023 Jun 27;14:1188520. doi: 10.3389/fimmu.2023.1188520. PMID: 37441065; PMCID: PMC10333567.